school
Общие знания
verified
Решено AI
Окислительно-восстановительные реакции (ОВР). Решение.
help_outline
Условие задачи
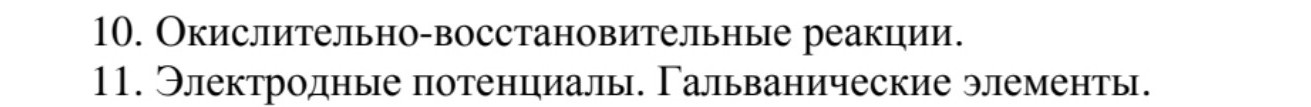
lightbulb
Краткий ответ
Окислительно-восстановительные реакции - это реакции с изменением степеней окисления атомов. Окисление - отдача электронов, восстановление - принятие электронов.
Подробное решение
Вот ответы на вопросы, оформленные так, чтобы было удобно переписать в тетрадь школьнику, с использованием MathJax для формул и без Markdown.
10. Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции (ОВР) – это химические реакции, в ходе которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих веществ. Это означает, что одни атомы отдают электроны (окисляются), а другие атомы принимают электроны (восстанавливаются).
Основные понятия:
* Окисление – процесс отдачи электронов атомом, ионом или молекулой. При окислении степень окисления элемента повышается.
* Восстановление – процесс присоединения электронов атомом, ионом или молекулой. При восстановлении степень окисления элемента понижается.
* Окислитель – вещество, которое принимает электроны и при этом восстанавливается.
* Восстановитель – вещество, которое отдает электроны и при этом окисляется.
Пример ОВР:
Реакция взаимодействия цинка с соляной кислотой:
\[ \text{Zn} + 2\text{HCl} \rightarrow \text{ZnCl}_2 + \text{H}_2 \]
Определим степени окисления элементов:
* В \(\text{Zn}\) (простое вещество) степень окисления 0.
* В \(\text{HCl}\): \(\text{H}\) имеет степень окисления +1, \(\text{Cl}\) имеет степень окисления -1.
* В \(\text{ZnCl}_2\): \(\text{Zn}\) имеет степень окисления +2, \(\text{Cl}\) имеет степень окисления -1.
* В \(\text{H}_2\) (простое вещество) степень окисления 0.
Изменения степеней окисления:
* \(\text{Zn}^0 \rightarrow \text{Zn}^{+2}\) (отдал 2 электрона, окислился)
* \(\text{H}^{+1} \rightarrow \text{H}^0\) (принял 1 электрон, восстановился)
Электронный баланс:
\[ \text{Zn}^0 - 2\text{e}^- \rightarrow \text{Zn}^{+2} \quad | \quad 1 \quad (\text{восстановитель, окисляется}) \]
\[ 2\text{H}^+ + 2\text{e}^- \rightarrow \text{H}_2^0 \quad | \quad 1 \quad (\text{окислитель, восстанавливается}) \]
В этой реакции цинк является восстановителем, а ионы водорода (\(\text{H}^+\)) из соляной кислоты – окислителем.
11. Электродные потенциалы. Гальванические элементы.
Электродные потенциалы.
Электродный потенциал – это разность электрических потенциалов, возникающая на границе раздела между электродом (металлом или другим проводником) и раствором электролита, в который он погружен. Эта разность потенциалов возникает из-за перехода ионов металла в раствор или осаждения ионов из раствора на металл, а также из-за перехода электронов.
Стандартный электродный потенциал (\(E^0\)) – это электродный потенциал, измеренный при стандартных условиях: температура 25 °C (298 K), концентрация ионов в растворе 1 моль/л, парциальное давление газов 1 атмосфера (101325 Па).
Стандартный водородный электрод (СВЭ) принят за эталон, его стандартный электродный потенциал равен нулю:
\[ E^0(\text{H}^+/\text{H}_2) = 0 \text{ В} \]
Значения стандартных электродных потенциалов позволяют предсказывать направление протекания окислительно-восстановительных реакций и рассчитывать ЭДС гальванических элементов.
Гальванические элементы.
Гальванический элемент (или электрохимический элемент, химический источник тока) – это устройство, которое преобразует химическую энергию окислительно-восстановительной реакции в электрическую энергию. Он состоит из двух полуэлементов (электродов), погруженных в растворы электролитов, соединенных между собой солевым мостиком и внешним проводником.
Принцип работы гальванического элемента:
В гальваническом элементе протекает самопроизвольная окислительно-восстановительная реакция. Электрод, на котором происходит окисление (отдача электронов), называется анодом (отрицательный полюс). Электрод, на котором происходит восстановление (прием электронов), называется катодом (положительный полюс). Электроны движутся от анода к катоду по внешнему проводнику, создавая электрический ток.
Пример гальванического элемента – элемент Даниэля-Якоби:
Он состоит из цинкового электрода, погруженного в раствор сульфата цинка (\(\text{ZnSO}_4\)), и медного электрода, погруженного в раствор сульфата меди (\(\text{CuSO}_4\)). Полуэлементы соединены солевым мостиком (например, с раствором \(\text{KCl}\)) и внешним проводником.
Реакции в элементе Даниэля:
* На аноде (цинк): \(\text{Zn} - 2\text{e}^- \rightarrow \text{Zn}^{2+}\) (окисление)
* На катоде (медь): \(\text{Cu}^{2+} + 2\text{e}^- \rightarrow \text{Cu}\) (восстановление)
Суммарная реакция:
\[ \text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu} \]
Электродвижущая сила (ЭДС) гальванического элемента:
ЭДС гальванического элемента (\(E\)) – это максимальная разность потенциалов между электродами, которая может быть получена от элемента. Она рассчитывается как разность стандартных электродных потенциалов катода и анода:
\[ E^0_{\text{элемента}} = E^0_{\text{катода}} - E^0_{\text{анода}} \]
Для элемента Даниэля:
\(E^0(\text{Cu}^{2+}/\text{Cu}) = +0.34 \text{ В}\)
\(E^0(\text{Zn}^{2+}/\text{Zn}) = -0.76 \text{ В}\)
\[ E^0_{\text{элемента}} = (+0.34 \text{ В}) - (-0.76 \text{ В}) = +1.10 \text{ В} \]
Положительное значение ЭДС указывает на самопроизвольность протекания реакции в данном направлении.