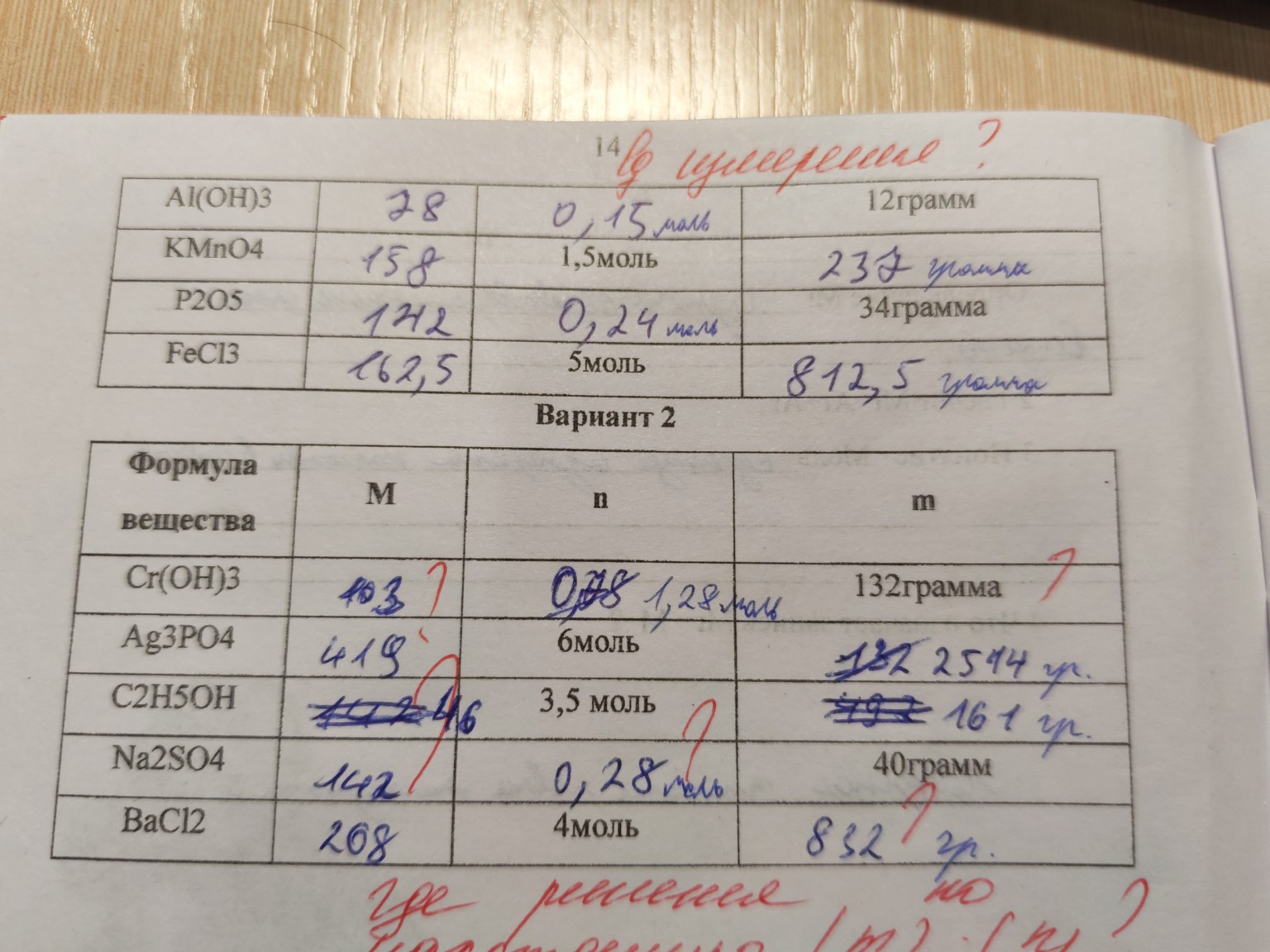
Хорошо, давайте решим эту задачу. В таблице представлены данные о различных веществах, и нужно заполнить пропущенные значения, используя формулы для расчета молярной массы (M), количества вещества (n) и массы (m).
Основные формулы, которые нам понадобятся:
1. Масса вещества: \(m = n \cdot M\)
2. Количество вещества: \(n = \frac{m}{M}\)
3. Молярная масса: \(M = \frac{m}{n}\)
Где:
* \(m\) - масса вещества (в граммах)
* \(n\) - количество вещества (в молях)
* \(M\) - молярная масса вещества (в г/моль)
Для решения нам также понадобятся атомные массы элементов из Периодической таблицы:
* Al (Алюминий) = 27 г/моль
* O (Кислород) = 16 г/моль
* H (Водород) = 1 г/моль
* K (Калий) = 39 г/моль
* Mn (Марганец) = 55 г/моль
* P (Фосфор) = 31 г/моль
* Fe (Железо) = 56 г/моль
* Cl (Хлор) = 35,5 г/моль
* Cr (Хром) = 52 г/моль
* Ag (Серебро) = 108 г/моль
* C (Углерод) = 12 г/моль
* Na (Натрий) = 23 г/моль
* S (Сера) = 32 г/моль
* Ba (Барий) = 137 г/моль
Давайте заполним таблицу по порядку.
Вариант 1
1.
Al(OH)3 (Гидроксид алюминия)
* Молярная масса \(M\):
\(M(\text{Al(OH)}_3) = M(\text{Al}) + 3 \cdot (M(\text{O}) + M(\text{H})) = 27 + 3 \cdot (16 + 1) = 27 + 3 \cdot 17 = 27 + 51 = 78 \text{ г/моль}\)
(В таблице уже указано 78 г/моль, это верно.)
* Количество вещества \(n\): 0,15 моль (дано)
* Масса \(m\):
\(m = n \cdot M = 0,15 \text{ моль} \cdot 78 \text{ г/моль} = 11,7 \text{ г}\)
(В таблице указано 12 грамм, что является округлением 11,7 г. Примем 12 г.)
2.
KMnO4 (Перманганат калия)
* Молярная масса \(M\):
\(M(\text{KMnO}_4) = M(\text{K}) + M(\text{Mn}) + 4 \cdot M(\text{O}) = 39 + 55 + 4 \cdot 16 = 39 + 55 + 64 = 158 \text{ г/моль}\)
(В таблице уже указано 158 г/моль, это верно.)
* Количество вещества \(n\): 1,5 моль (дано)
* Масса \(m\):
\(m = n \cdot M = 1,5 \text{ моль} \cdot 158 \text{ г/моль} = 237 \text{ г}\)
(В таблице указано 237 грамм, это верно.)
3.
P2O5 (Оксид фосфора(V))
* Молярная масса \(M\):
\(M(\text{P}_2\text{O}_5) = 2 \cdot M(\text{P}) + 5 \cdot M(\text{O}) = 2 \cdot 31 + 5 \cdot 16 = 62 + 80 = 142 \text{ г/моль}\)
(В таблице уже указано 142 г/моль, это верно.)
* Количество вещества \(n\): 0,24 моль (дано)
* Масса \(m\):
\(m = n \cdot M = 0,24 \text{ моль} \cdot 142 \text{ г/моль} = 34,08 \text{ г}\)
(В таблице указано 34 грамма, что является округлением 34,08 г. Примем 34 г.)
4.
FeCl3 (Хлорид железа(III))
* Молярная масса \(M\):
\(M(\text{FeCl}_3) = M(\text{Fe}) + 3 \cdot M(\text{Cl}) = 56 + 3 \cdot 35,5 = 56 + 106,5 = 162,5 \text{ г/моль}\)
(В таблице уже указано 162,5 г/моль, это верно.)
* Количество вещества \(n\): 5 моль (дано)
* Масса \(m\):
\(m = n \cdot M = 5 \text{ моль} \cdot 162,5 \text{ г/моль} = 812,5 \text{ г}\)
(В таблице указано 812,5 грамма, это верно.)
Вариант 2
1.
Cr(OH)3 (Гидроксид хрома(III))
* Молярная масса \(M\):
\(M(\text{Cr(OH)}_3) = M(\text{Cr}) + 3 \cdot (M(\text{O}) + M(\text{H})) = 52 + 3 \cdot (16 + 1) = 52 + 3 \cdot 17 = 52 + 51 = 103 \text{ г/моль}\)
(В таблице указано 103 г/моль, это верно.)
* Масса \(m\): 132 грамма (дано)
* Количество вещества \(n\):
\(n = \frac{m}{M} = \frac{132 \text{ г}}{103 \text{ г/моль}} \approx 1,28 \text{ моль}\)
(В таблице указано 0,78 моль, затем исправлено на 1,28 моль. Расчет подтверждает 1,28 моль.)
2.
Ag3PO4 (Фосфат серебра)
* Количество вещества \(n\): 6 моль (дано)
* Молярная масса \(M\):
\(M(\text{Ag}_3\text{PO}_4) = 3 \cdot M(\text{Ag}) + M(\text{P}) + 4 \cdot M(\text{O}) = 3 \cdot 108 + 31 + 4 \cdot 16 = 324 + 31 + 64 = 419 \text{ г/моль}\)
(В таблице указано 419 г/моль, это верно.)
* Масса \(m\):
\(m = n \cdot M = 6 \text{ моль} \cdot 419 \text{ г/моль} = 2514 \text{ г}\)
(В таблице указано 2514 гр, это верно.)
3.
C2H5OH (Этанол)
* Количество вещества \(n\): 3,5 моль (дано)
* Молярная масса \(M\):
\(M(\text{C}_2\text{H}_5\text{OH}) = 2 \cdot M(\text{C}) + 6 \cdot M(\text{H}) + M(\text{O}) = 2 \cdot 12 + 6 \cdot 1 + 16 = 24 + 6 + 16 = 46 \text{ г/моль}\)
(В таблице указано 46 г/моль, это верно.)
* Масса \(m\):
\(m = n \cdot M = 3,5 \text{ моль} \cdot 46 \text{ г/моль} = 161 \text{ г}\)
(В таблице указано 161 гр, это верно.)
4.
Na2SO4 (Сульфат натрия)
* Молярная масса \(M\):
\(M(\text{Na}_2\text{SO}_4) = 2 \cdot M(\text{Na}) + M(\text{S}) + 4 \cdot M(\text{O}) = 2 \cdot 23 + 32 + 4 \cdot 16 = 46 + 32 + 64 = 142 \text{ г/моль}\)
(В таблице указано 142 г/моль, это верно.)
* Масса \(m\): 40 грамм (дано)
* Количество вещества \(n\):
\(n = \frac{m}{M} = \frac{40 \text{ г}}{142 \text{ г/моль}} \approx 0,28 \text{ моль}\)
(В таблице указано 0,28 моль, это верно.)
5.
BaCl2 (Хлорид бария)
* Количество вещества \(n\): 4 моль (дано)
* Молярная масса \(M\):
\(M(\text{BaCl}_2) = M(\text{Ba}) + 2 \cdot M(\text{Cl}) = 137 + 2 \cdot 35,5 = 137 + 71 = 208 \text{ г/моль}\)
(В таблице указано 208 г/моль, это верно.)
* Масса \(m\):
\(m = n \cdot M = 4 \text{ моль} \cdot 208 \text{ г/моль} = 832 \text{ г}\)
(В таблице указано 832 гр, это верно.)
Итоговая заполненная таблица
| Формула вещества |
M (г/моль) |
n (моль) |
m (грамм) |
| Вариант 1 |
| Al(OH)3 |
78 |
0,15 |
12 |
| KMnO4 |
158 |
1,5 |
237 |
| P2O5 |
142 |
0,24 |
34 |
| FeCl3 |
162,5 |
5 |
812,5 |
| Вариант 2 |
| Cr(OH)3 |
103 |
1,28 |
132 |
| Ag3PO4 |
419 |
6 |
2514 |
| C2H5OH |
46 |
3,5 |
161 |
| Na2SO4 |
142 |
0,28 |
40 |
| BaCl2 |
208 |
4 |
832 |
Все значения в таблице, которые были даны или исправлены, соответствуют расчетам.