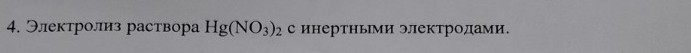4. Электролиз раствора Hg(NO3)2 с инертными электродами.
1. Диссоциация соли в растворе:
При растворении нитрата ртути(II) в воде происходит его диссоциация на ионы:
\[ \text{Hg(NO}_3\text{)}_2 \rightleftharpoons \text{Hg}^{2+} + 2\text{NO}_3^- \]Также в растворе присутствует вода, которая незначительно диссоциирует:
\[ \text{H}_2\text{O} \rightleftharpoons \text{H}^+ + \text{OH}^- \]2. Процессы на катоде (отрицательный электрод):
На катоде происходит восстановление. К катоду движутся положительно заряженные ионы (катионы): \( \text{Hg}^{2+} \) и \( \text{H}^+ \).
Сравниваем стандартные электродные потенциалы восстановления:
- \( \text{Hg}^{2+} + 2e^- \rightarrow \text{Hg} \quad (E^0 = +0.85 \text{ В}) \)
- \( 2\text{H}_2\text{O} + 2e^- \rightarrow \text{H}_2 \uparrow + 2\text{OH}^- \quad (E^0 = -0.83 \text{ В при pH 7}) \)
- \( 2\text{H}^+ + 2e^- \rightarrow \text{H}_2 \uparrow \quad (E^0 = 0.00 \text{ В}) \)
Поскольку потенциал восстановления ионов ртути(II) значительно выше, чем потенциал восстановления воды или ионов водорода (в нейтральной или кислой среде), на катоде в первую очередь будут восстанавливаться ионы ртути(II) до металлической ртути.
Катодный процесс:
\[ \text{Hg}^{2+} + 2e^- \rightarrow \text{Hg} \]3. Процессы на аноде (положительный электрод):
На аноде происходит окисление. К аноду движутся отрицательно заряженные ионы (анионы): \( \text{NO}_3^- \) и \( \text{OH}^- \) (из воды).
Сравниваем стандартные электродные потенциалы окисления (или потенциалы восстановления, но с обратным знаком):
- Окисление нитрат-ионов \( \text{NO}_3^- \) очень затруднено, так как азот в них находится в высшей степени окисления (+5). Потенциал окисления \( \text{NO}_3^- \) очень высокий, поэтому они практически не окисляются в водных растворах.
- Окисление воды: \( 2\text{H}_2\text{O} - 4e^- \rightarrow \text{O}_2 \uparrow + 4\text{H}^+ \quad (E^0 = -1.23 \text{ В}) \)
- Окисление гидроксид-ионов: \( 4\text{OH}^- - 4e^- \rightarrow \text{O}_2 \uparrow + 2\text{H}_2\text{O} \quad (E^0 = -0.40 \text{ В при pH 14}) \)
Поскольку нитрат-ионы не окисляются, а инертные электроды не участвуют в реакции, на аноде будет окисляться вода с выделением кислорода.
Анодный процесс:
\[ 2\text{H}_2\text{O} - 4e^- \rightarrow \text{O}_2 \uparrow + 4\text{H}^+ \]4. Суммарное уравнение электролиза:
Для получения суммарного уравнения нужно уравнять количество электронов в катодном и анодном процессах. Катодный процесс умножаем на 2:
Катод: \( 2\text{Hg}^{2+} + 4e^- \rightarrow 2\text{Hg} \)
Анод: \( 2\text{H}_2\text{O} - 4e^- \rightarrow \text{O}_2 \uparrow + 4\text{H}^+ \)
Складываем эти два уравнения:
\[ 2\text{Hg}^{2+} + 2\text{H}_2\text{O} \xrightarrow{\text{электролиз}} 2\text{Hg} + \text{O}_2 \uparrow + 4\text{H}^+ \]Учитывая, что ионы \( \text{Hg}^{2+} \) поступают из \( \text{Hg(NO}_3\text{)}_2 \), а ионы \( \text{H}^+ \) образуются в растворе, которые затем могут соединяться с \( \text{NO}_3^- \) в азотную кислоту, полное уравнение электролиза будет выглядеть так:
\[ 2\text{Hg(NO}_3\text{)}_2 + 2\text{H}_2\text{O} \xrightarrow{\text{электролиз}} 2\text{Hg} + \text{O}_2 \uparrow + 4\text{HNO}_3 \]5. Наблюдаемые явления:
- На катоде выделяется металлическая ртуть (жидкий металл серебристого цвета).
- На аноде выделяется газообразный кислород.
- В растворе накапливается азотная кислота, что приводит к подкислению раствора.