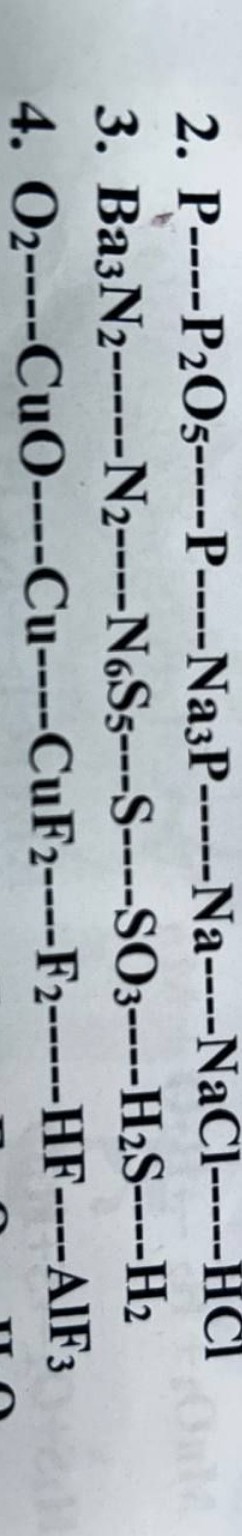Цепочка 2:
\(\text{P} \longrightarrow \text{P}_2\text{O}_5 \longrightarrow \text{P} \longrightarrow \text{Na}_3\text{P} \longrightarrow \text{Na} \longrightarrow \text{NaCl} \longrightarrow \text{HCl}\)
1. \(\text{P} \longrightarrow \text{P}_2\text{O}_5\)
Фосфор реагирует с кислородом, образуя оксид фосфора(V).
\(4\text{P} + 5\text{O}_2 \longrightarrow 2\text{P}_2\text{O}_5\)
2. \(\text{P}_2\text{O}_5 \longrightarrow \text{P}\)
Оксид фосфора(V) можно восстановить до фосфора, например, с помощью угля при высокой температуре.
\(\text{P}_2\text{O}_5 + 5\text{C} \longrightarrow 2\text{P} + 5\text{CO}\)
3. \(\text{P} \longrightarrow \text{Na}_3\text{P}\)
Фосфор реагирует с натрием, образуя фосфид натрия.
\(2\text{P} + 6\text{Na} \longrightarrow 2\text{Na}_3\text{P}\)
4. \(\text{Na}_3\text{P} \longrightarrow \text{Na}\)
Фосфид натрия можно разложить до натрия и фосфора при нагревании, но чаще натрий получают электролизом расплава солей.
Например, электролиз расплава хлорида натрия:
\(2\text{NaCl} \xrightarrow{\text{электролиз}} 2\text{Na} + \text{Cl}_2\)
Если нужно получить натрий именно из фосфида натрия, это сложный процесс, обычно не используемый для получения чистого натрия. Возможно, здесь подразумевается получение натрия из другого соединения, например, из хлорида натрия, который является более распространенным источником.
5. \(\text{Na} \longrightarrow \text{NaCl}\)
Натрий реагирует с хлором, образуя хлорид натрия.
\(2\text{Na} + \text{Cl}_2 \longrightarrow 2\text{NaCl}\)
6. \(\text{NaCl} \longrightarrow \text{HCl}\)
Хлорид натрия реагирует с концентрированной серной кислотой при нагревании, образуя хлороводород (который растворяется в воде, образуя соляную кислоту).
\(\text{NaCl} + \text{H}_2\text{SO}_4 (\text{конц.}) \xrightarrow{t} \text{NaHSO}_4 + \text{HCl}\)
Цепочка 3:
\(\text{Ba}_3\text{N}_2 \longrightarrow \text{N}_2 \longrightarrow \text{N}_6\text{S}_5 \longrightarrow \text{S} \longrightarrow \text{SO}_3 \longrightarrow \text{H}_2\text{S} \longrightarrow \text{H}_2\)
1. \(\text{Ba}_3\text{N}_2 \longrightarrow \text{N}_2\)
Нитрид бария разлагается при нагревании, образуя азот и барий.
\(\text{Ba}_3\text{N}_2 \xrightarrow{t} 3\text{Ba} + \text{N}_2\)
2. \(\text{N}_2 \longrightarrow \text{N}_6\text{S}_5\)
Формула \(\text{N}_6\text{S}_5\) не является стандартным химическим соединением. Возможно, это опечатка или очень специфическое соединение. Если это опечатка, и имелось в виду, например, получение серы из азота, то это невозможно напрямую. Если это соединение существует, то его получение из азота будет сложным и многостадийным процессом, не характерным для школьной химии. Предположим, что это опечатка и имелось в виду что-то другое, или же это просто переход к сере.
Если же это просто переход к сере, то азот не может напрямую превратиться в серу.
3. \(\text{N}_6\text{S}_5 \longrightarrow \text{S}\)
Если \(\text{N}_6\text{S}_5\) - это некое соединение серы и азота, то серу из него можно получить, например, термическим разложением или реакцией с восстановителем.
Например, если это соединение разлагается:
\(\text{N}_6\text{S}_5 \xrightarrow{t} 3\text{N}_2 + 5\text{S}\) (это гипотетическая реакция, так как соединение нестандартное)
4. \(\text{S} \longrightarrow \text{SO}_3\)
Сера сначала сгорает в кислороде до диоксида серы, а затем диоксид серы окисляется до триоксида серы в присутствии катализатора (например, \(\text{V}_2\text{O}_5\)).
\(\text{S} + \text{O}_2 \longrightarrow \text{SO}_2\)
\(2\text{SO}_2 + \text{O}_2 \xrightarrow{\text{V}_2\text{O}_5, t} 2\text{SO}_3\)
5. \(\text{SO}_3 \longrightarrow \text{H}_2\text{S}\)
Триоксид серы - это кислотный оксид. Для получения сероводорода (\(\text{H}_2\text{S}\)) из него, нужно сначала получить серную кислоту, а затем восстановить ее. Или же восстановить сам \(\text{SO}_3\).
Например, \(\text{SO}_3\) реагирует с водой, образуя серную кислоту:
\(\text{SO}_3 + \text{H}_2\text{O} \longrightarrow \text{H}_2\text{SO}_4\)
Затем серную кислоту можно восстановить до сероводорода, например, с помощью йодоводородной кислоты или других сильных восстановителей.
\(\text{H}_2\text{SO}_4 (\text{конц.}) + 8\text{HI} \longrightarrow \text{H}_2\text{S} + 4\text{I}_2 + 4\text{H}_2\text{O}\)
Или прямое восстановление \(\text{SO}_3\) (менее типично для школьной химии):
\(\text{SO}_3 + 4\text{H}_2 \xrightarrow{t} \text{H}_2\text{S} + 3\text{H}_2\text{O}\)
6. \(\text{H}_2\text{S} \longrightarrow \text{H}_2\)
Сероводород можно разложить на водород и серу при высокой температуре.
\(2\text{H}_2\text{S} \xrightarrow{t} 2\text{H}_2 + 2\text{S}\)
Цепочка 4:
\(\text{O}_2 \longrightarrow \text{CuO} \longrightarrow \text{Cu} \longrightarrow \text{CuF}_2 \longrightarrow \text{F}_2 \longrightarrow \text{HF} \longrightarrow \text{AlF}_3\)
1. \(\text{O}_2 \longrightarrow \text{CuO}\)
Кислород реагирует с медью при нагревании, образуя оксид меди(II).
\(2\text{Cu} + \text{O}_2 \xrightarrow{t} 2\text{CuO}\)
Здесь, вероятно, подразумевается, что сначала есть медь, которая реагирует с кислородом. Если же исходное вещество только \(\text{O}_2\), то нужно сначала получить медь, что не показано в цепочке. Предположим, что медь доступна.
2. \(\text{CuO} \longrightarrow \text{Cu}\)
Оксид меди(II) можно восстановить до меди, например, с помощью водорода, угарного газа или угля при нагревании.
\(\text{CuO} + \text{H}_2 \xrightarrow{t} \text{Cu} + \text{H}_2\text{O}\)
или
\(\text{CuO} + \text{CO} \xrightarrow{t} \text{Cu} + \text{CO}_2\)
3. \(\text{Cu} \longrightarrow \text{CuF}_2\)
Медь реагирует с фтором, образуя фторид меди(II).
\(\text{Cu} + \text{F}_2 \longrightarrow \text{CuF}_2\)
4. \(\text{CuF}_2 \longrightarrow \text{F}_2\)
Фторид меди(II) можно разложить до фтора и меди при электролизе расплава.
\(\text{CuF}_2 \xrightarrow{\text{электролиз}} \text{Cu} + \text{F}_2\)
5. \(\text{F}_2 \longrightarrow \text{HF}\)
Фтор реагирует с водородом, образуя фтороводород.
\(\text{H}_2 + \text{F}_2 \longrightarrow 2\text{HF}\)
6. \(\text{HF} \longrightarrow \text{AlF}_3\)
Фтороводород (или плавиковая кислота) реагирует с алюминием или оксидом алюминия, образуя фторид алюминия.
С алюминием:
\(2\text{Al} + 6\text{HF} \longrightarrow 2\text{AlF}_3 + 3\text{H}_2\)
С оксидом алюминия:
\(\text{Al}_2\text{O}_3 + 6\text{HF} \longrightarrow 2\text{AlF}_3 + 3\text{H}_2\text{O}\)