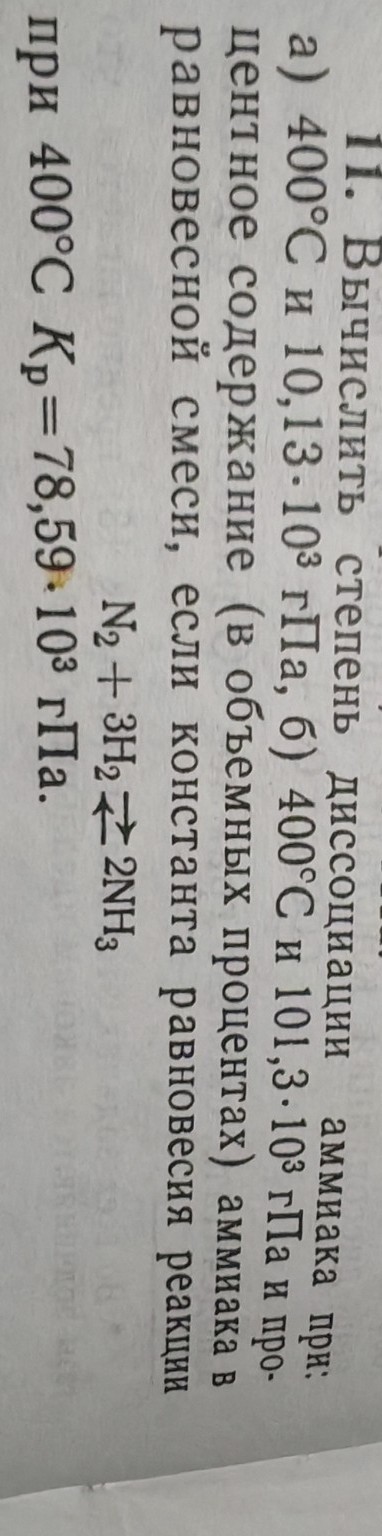Задача 11. Вычислить степень диссоциации аммиака при:
а) 400°C и 101,3·103 Па,
б) 400°C и 101,3·103 Па и процентное содержание (в объемных процентах) аммиака в равновесной смеси, если константа равновесия реакции N2 + 3H2 ⇌ 2NH3 при 400°C Kp = 78,59·103 Па.
Дано:
- Температура \(T = 400^\circ C\)
- Давление \(P = 101,3 \cdot 10^3\) Па
- Константа равновесия реакции N2 + 3H2 ⇌ 2NH3 при 400°C: \(K_p = 78,59 \cdot 10^3\) Па
Найти:
- Степень диссоциации аммиака \(\alpha\) при заданных условиях.
- Процентное содержание аммиака в равновесной смеси.
Решение:
Сначала переведем температуру из градусов Цельсия в Кельвины:
\[T = 400^\circ C + 273,15 = 673,15 \text{ K}\]Реакция, для которой дана константа равновесия, это синтез аммиака:
\[\text{N}_2 + 3\text{H}_2 \rightleftharpoons 2\text{NH}_3\]Нам нужно найти степень диссоциации аммиака, то есть распад аммиака. Обратная реакция:
\[2\text{NH}_3 \rightleftharpoons \text{N}_2 + 3\text{H}_2\]Константа равновесия для реакции диссоциации аммиака \(K_p'\) будет обратной величиной константы равновесия для синтеза аммиака, возведенной в степень, соответствующую стехиометрическим коэффициентам. Поскольку реакция диссоциации является обратной к реакции синтеза, и коэффициенты для аммиака в реакции диссоциации (2) соответствуют коэффициентам в реакции синтеза (2), то:
\[K_p' = \frac{1}{K_p} = \frac{1}{78,59 \cdot 10^3 \text{ Па}}\] \[K_p' \approx 1,272 \cdot 10^{-5} \text{ Па}^{-1}\]Теперь запишем выражение для константы равновесия \(K_p'\) через парциальные давления продуктов и реагентов:
\[K_p' = \frac{P_{\text{N}_2} \cdot P_{\text{H}_2}^3}{P_{\text{NH}_3}^2}\]Пусть изначально у нас был 1 моль аммиака. Если степень диссоциации аммиака равна \(\alpha\), то:
- Количество прореагировавшего аммиака: \(2\alpha\) моль (из 2 моль NH3) или \(\alpha\) моль (из 1 моль NH3). Удобнее считать, что изначально было 2 моль NH3, тогда прореагирует \(2\alpha\) моль.
- Остаток аммиака: \(2 - 2\alpha\) моль
- Образовалось азота: \(\alpha\) моль
- Образовалось водорода: \(3\alpha\) моль
Общее количество молей в равновесной смеси:
\[n_{общ} = (2 - 2\alpha) + \alpha + 3\alpha = 2 + 2\alpha\]Мольные доли компонентов в равновесной смеси:
\[x_{\text{NH}_3} = \frac{2 - 2\alpha}{2 + 2\alpha} = \frac{1 - \alpha}{1 + \alpha}\] \[x_{\text{N}_2} = \frac{\alpha}{2 + 2\alpha} = \frac{\alpha}{2(1 + \alpha)}\] \[x_{\text{H}_2} = \frac{3\alpha}{2 + 2\alpha} = \frac{3\alpha}{2(1 + \alpha)}\]Парциальные давления компонентов:
\[P_i = x_i \cdot P\] \[P_{\text{NH}_3} = \frac{1 - \alpha}{1 + \alpha} \cdot P\] \[P_{\text{N}_2} = \frac{\alpha}{2(1 + \alpha)} \cdot P\] \[P_{\text{H}_2} = \frac{3\alpha}{2(1 + \alpha)} \cdot P\]Подставим эти выражения в формулу для \(K_p'\):
\[K_p' = \frac{\left(\frac{\alpha}{2(1 + \alpha)} P\right) \cdot \left(\frac{3\alpha}{2(1 + \alpha)} P\right)^3}{\left(\frac{1 - \alpha}{1 + \alpha} P\right)^2}\] \[K_p' = \frac{\frac{\alpha P}{2(1 + \alpha)} \cdot \frac{27\alpha^3 P^3}{8(1 + \alpha)^3}}{\frac{(1 - \alpha)^2 P^2}{(1 + \alpha)^2}}\] \[K_p' = \frac{27\alpha^4 P^4}{16(1 + \alpha)^4} \cdot \frac{(1 + \alpha)^2}{(1 - \alpha)^2 P^2}\] \[K_p' = \frac{27\alpha^4 P^2}{16(1 + \alpha)^2 (1 - \alpha)^2}\] \[K_p' = \frac{27\alpha^4 P^2}{16(1 - \alpha^2)^2}\]Теперь выразим \(\alpha\). Поскольку степень диссоциации аммиака при таких условиях обычно мала, можно предположить, что \(\alpha \ll 1\). В этом случае \((1 - \alpha^2)^2 \approx 1\).
Тогда упрощенная формула:
\[K_p' \approx \frac{27\alpha^4 P^2}{16}\] \[\alpha^4 = \frac{16 K_p'}{27 P^2}\] \[\alpha = \left(\frac{16 K_p'}{27 P^2}\right)^{1/4}\]Подставляем значения:
\[K_p' = 1,272 \cdot 10^{-5} \text{ Па}^{-1}\] \[P = 101,3 \cdot 10^3 \text{ Па}\] \[P^2 = (101,3 \cdot 10^3)^2 = 10261690000 \text{ Па}^2 \approx 1,026 \cdot 10^{10} \text{ Па}^2\] \[\alpha = \left(\frac{16 \cdot 1,272 \cdot 10^{-5} \text{ Па}^{-1}}{27 \cdot (1,026 \cdot 10^{10} \text{ Па}^2)}\right)^{1/4}\]Здесь есть ошибка в размерности \(K_p'\). Если \(K_p\) для реакции N2 + 3H2 ⇌ 2NH3 имеет размерность Па-2 (поскольку \(\Delta n = 2 - (1+3) = -2\)), то \(K_p'\) для реакции 2NH3 ⇌ N2 + 3H2 будет иметь размерность Па2 (поскольку \(\Delta n = (1+3) - 2 = 2\)).
Пересчитаем \(K_p'\) с учетом размерности. Для реакции N2 + 3H2 ⇌ 2NH3: \[K_p = \frac{P_{\text{NH}_3}^2}{P_{\text{N}_2} \cdot P_{\text{H}_2}^3}\] Размерность \(K_p\) будет \(\frac{\text{Па}^2}{\text{Па} \cdot \text{Па}^3} = \text{Па}^{-2}\). Значит, \(K_p = 78,59 \cdot 10^3 \text{ Па}^{-2}\) (предполагаем, что в задаче опечатка в размерности, и она должна быть Па-2, иначе значение \(K_p\) слишком большое для константы, выраженной в Па). Если \(K_p = 78,59 \cdot 10^3 \text{ Па}^{-2}\), то \(K_p'\) для диссоциации будет: \[K_p' = \frac{1}{K_p} = \frac{1}{78,59 \cdot 10^3 \text{ Па}^{-2}} = 1,272 \cdot 10^{-5} \text{ Па}^2\]
Теперь подставим это значение \(K_p'\) в формулу:
\[K_p' = \frac{27\alpha^4 P^2}{16(1 - \alpha^2)^2}\]Если \(K_p'\) имеет размерность Па2, то в правой части должно быть \(P^{\Delta n}\). Для реакции диссоциации \(\Delta n = (1+3) - 2 = 2\). Значит, в выражении для \(K_p'\) должно быть \(P^2\).
Перепишем выражение для \(K_p'\) через мольные доли и общее давление \(P\):
\[K_p' = \frac{x_{\text{N}_2} \cdot x_{\text{H}_2}^3}{x_{\text{NH}_3}^2} \cdot P^{\Delta n}\] \[K_p' = \frac{\left(\frac{\alpha}{2(1 + \alpha)}\right) \cdot \left(\frac{3\alpha}{2(1 + \alpha)}\right)^3}{\left(\frac{1 - \alpha}{1 + \alpha}\right)^2} \cdot P^2\] \[K_p' = \frac{\frac{\alpha}{2(1 + \alpha)} \cdot \frac{27\alpha^3}{8(1 + \alpha)^3}}{\frac{(1 - \alpha)^2}{(1 + \alpha)^2}} \cdot P^2\] \[K_p' = \frac{27\alpha^4}{16(1 + \alpha)^4} \cdot \frac{(1 + \alpha)^2}{(1 - \alpha)^2} \cdot P^2\] \[K_p' = \frac{27\alpha^4 P^2}{16(1 - \alpha^2)^2}\]Это выражение верно. Теперь подставляем значения:
\[1,272 \cdot 10^{-5} \text{ Па}^2 = \frac{27\alpha^4 \cdot (101,3 \cdot 10^3 \text{ Па})^2}{16(1 - \alpha^2)^2}\] \[1,272 \cdot 10^{-5} = \frac{27\alpha^4 \cdot 1,026 \cdot 10^{10}}{16(1 - \alpha^2)^2}\] \[1,272 \cdot 10^{-5} = \frac{2,7702 \cdot 10^{11} \alpha^4}{16(1 - \alpha^2)^2}\] \[1,272 \cdot 10^{-5} \cdot 16 = 2,7702 \cdot 10^{11} \alpha^4\] \[2,0352 \cdot 10^{-4} = 2,7702 \cdot 10^{11} \alpha^4\] \[\alpha^4 = \frac{2,0352 \cdot 10^{-4}}{2,7702 \cdot 10^{11}} = 0,7346 \cdot 10^{-15} = 7,346 \cdot 10^{-16}\] \[\alpha = (7,346 \cdot 10^{-16})^{1/4}\] \[\alpha \approx 0,00925\]Проверим допущение \(\alpha \ll 1\). \(0,00925\) действительно мало по сравнению с 1, так что допущение оправдано.
а) Степень диссоциации аммиака:
\[\alpha \approx 0,00925\]б) Процентное содержание аммиака в равновесной смеси:
Мольная доля аммиака \(x_{\text{NH}_3} = \frac{1 - \alpha}{1 + \alpha}\)
\[x_{\text{NH}_3} = \frac{1 - 0,00925}{1 + 0,00925} = \frac{0,99075}{1,00925} \approx 0,98167\]Процентное содержание аммиака (объемные проценты равны мольным процентам для идеальных газов):
\[\text{Объемное содержание NH}_3 = x_{\text{NH}_3} \cdot 100\% = 0,98167 \cdot 100\% \approx 98,17\%\]Ответ:
а) Степень диссоциации аммиака при 400°C и 101,3·103 Па составляет примерно \(\alpha = 0,00925\).
б) Процентное содержание аммиака в равновесной смеси составляет примерно \(98,17\%\).