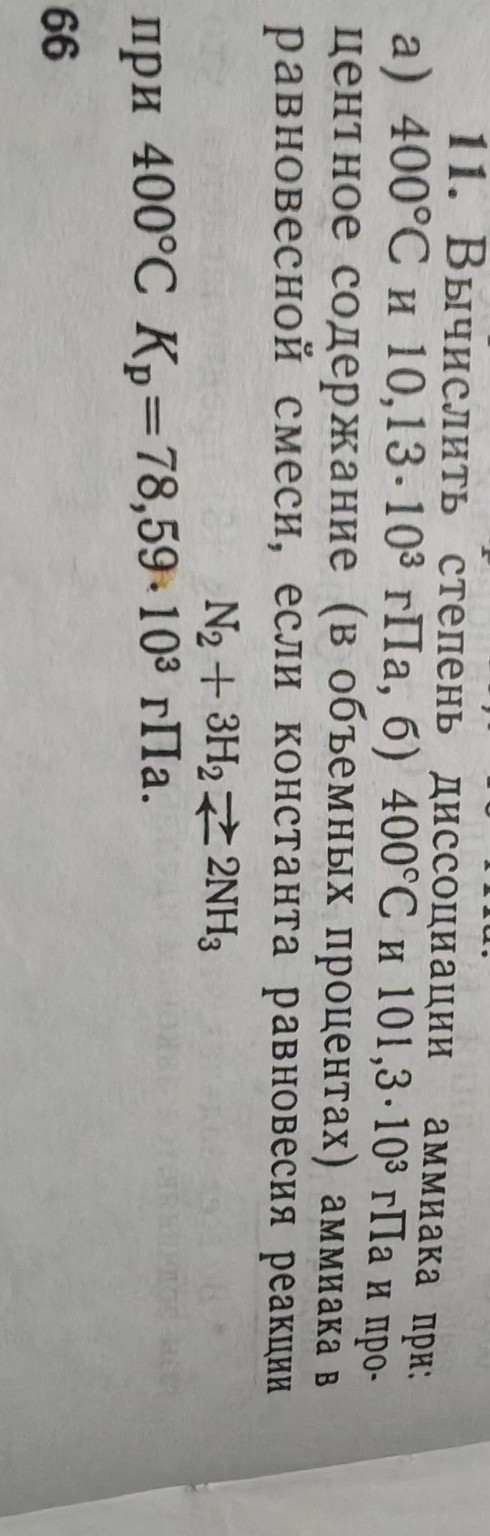Задача 11.
Вычислить степень диссоциации аммиака при:
а) 400°C и 10,13·103 гПа,
б) 400°C и 101,3·103 гПа и процентное содержание (в объемных процентах) аммиака в равновесной смеси, если константа равновесия реакции
N2 + 3H2 ⇌ 2NH3
при 400°C Kp = 78,59·103 гПа.
Решение:
Дана реакция синтеза аммиака:
N2 + 3H2 ⇌ 2NH3
В задаче требуется вычислить степень диссоциации аммиака, то есть мы рассматриваем обратную реакцию – разложение аммиака:
2NH3 ⇌ N2 + 3H2
Для этой реакции константа равновесия Kp' будет обратна константе Kp для реакции синтеза:
\[K_p' = \frac{1}{K_p} = \frac{1}{78,59 \cdot 10^3 \text{ гПа}} = \frac{1}{78,59 \cdot 10^3 \cdot 10^{-5} \text{ атм}} = \frac{1}{78,59 \cdot 10^{-2} \text{ атм}} = \frac{1}{0,7859 \text{ атм}} \approx 1,272 \text{ атм}^{-1}\]Примечание: 1 гПа = 10-5 атм.
Пусть начальное количество аммиака равно 1 моль. Если степень диссоциации аммиака равна \(\alpha\), то в равновесии будет:
- NH3: \(1 - \alpha\) моль
- N2: \(\frac{\alpha}{2}\) моль
- H2: \(\frac{3\alpha}{2}\) моль
Общее количество молей в равновесии:
\[n_{общ} = (1 - \alpha) + \frac{\alpha}{2} + \frac{3\alpha}{2} = 1 - \alpha + \frac{4\alpha}{2} = 1 - \alpha + 2\alpha = 1 + \alpha\]Парциальные давления компонентов выражаются через их мольные доли и общее давление \(P\):
\[P_{NH_3} = \frac{1 - \alpha}{1 + \alpha} \cdot P\] \[P_{N_2} = \frac{\frac{\alpha}{2}}{1 + \alpha} \cdot P = \frac{\alpha}{2(1 + \alpha)} \cdot P\] \[P_{H_2} = \frac{\frac{3\alpha}{2}}{1 + \alpha} \cdot P = \frac{3\alpha}{2(1 + \alpha)} \cdot P\]Константа равновесия Kp' для реакции диссоциации аммиака:
\[K_p' = \frac{P_{N_2} \cdot P_{H_2}^3}{P_{NH_3}^2}\] \[K_p' = \frac{\frac{\alpha}{2(1 + \alpha)} \cdot P \cdot \left(\frac{3\alpha}{2(1 + \alpha)} \cdot P\right)^3}{\left(\frac{1 - \alpha}{1 + \alpha} \cdot P\right)^2}\] \[K_p' = \frac{\frac{\alpha}{2(1 + \alpha)} \cdot P \cdot \frac{27\alpha^3}{8(1 + \alpha)^3} \cdot P^3}{\frac{(1 - \alpha)^2}{(1 + \alpha)^2} \cdot P^2}\] \[K_p' = \frac{\frac{27\alpha^4}{16(1 + \alpha)^4} \cdot P^4}{\frac{(1 - \alpha)^2}{(1 + \alpha)^2} \cdot P^2}\] \[K_p' = \frac{27\alpha^4 \cdot P^2}{16(1 - \alpha)^2 (1 + \alpha)^2}\] \[K_p' = \frac{27\alpha^4 \cdot P^2}{16(1 - \alpha^2)^2}\]Отсюда выразим \(\alpha\):
\[K_p' \cdot 16(1 - \alpha^2)^2 = 27\alpha^4 \cdot P^2\] \[\frac{16 K_p'}{27 P^2} = \frac{\alpha^4}{(1 - \alpha^2)^2} = \left(\frac{\alpha^2}{1 - \alpha^2}\right)^2\] \[\sqrt{\frac{16 K_p'}{27 P^2}} = \frac{\alpha^2}{1 - \alpha^2}\] \[\frac{4}{P} \sqrt{\frac{K_p'}{27}} = \frac{\alpha^2}{1 - \alpha^2}\]Обозначим \(X = \frac{4}{P} \sqrt{\frac{K_p'}{27}}\). Тогда:
\[X = \frac{\alpha^2}{1 - \alpha^2}\] \[X(1 - \alpha^2) = \alpha^2\] \[X - X\alpha^2 = \alpha^2\] \[X = \alpha^2 + X\alpha^2\] \[X = \alpha^2(1 + X)\] \[\alpha^2 = \frac{X}{1 + X}\] \[\alpha = \sqrt{\frac{X}{1 + X}}\]Теперь подставим значения для каждого случая.
а) Давление \(P = 10,13 \cdot 10^3 \text{ гПа}\)
Переведем давление в атмосферы:
\[P = 10,13 \cdot 10^3 \text{ гПа} = 10,13 \cdot 10^3 \cdot 10^{-5} \text{ атм} = 10,13 \cdot 10^{-2} \text{ атм} = 0,1013 \text{ атм}\]Рассчитаем \(X\):
\[X = \frac{4}{0,1013} \sqrt{\frac{1,272}{27}} = \frac{4}{0,1013} \sqrt{0,04711} = \frac{4}{0,1013} \cdot 0,21705 \approx 4,00\]Теперь найдем \(\alpha\):
\[\alpha = \sqrt{\frac{4,00}{1 + 4,00}} = \sqrt{\frac{4,00}{5,00}} = \sqrt{0,8} \approx 0,894\]Степень диссоциации аммиака составляет 0,894 или 89,4%.
б) Давление \(P = 101,3 \cdot 10^3 \text{ гПа}\)
Переведем давление в атмосферы:
\[P = 101,3 \cdot 10^3 \text{ гПа} = 101,3 \cdot 10^3 \cdot 10^{-5} \text{ атм} = 101,3 \cdot 10^{-2} \text{ атм} = 1,013 \text{ атм}\]Рассчитаем \(X\):
\[X = \frac{4}{1,013} \sqrt{\frac{1,272}{27}} = \frac{4}{1,013} \sqrt{0,04711} = \frac{4}{1,013} \cdot 0,21705 \approx 0,856\]Теперь найдем \(\alpha\):
\[\alpha = \sqrt{\frac{0,856}{1 + 0,856}} = \sqrt{\frac{0,856}{1,856}} = \sqrt{0,4612} \approx 0,679\]Степень диссоциации аммиака составляет 0,679 или 67,9%.
Теперь найдем процентное содержание аммиака в равновесной смеси для случая б).
Мольная доля аммиака в равновесной смеси:
\[x_{NH_3} = \frac{1 - \alpha}{1 + \alpha}\]Подставим \(\alpha = 0,679\):
\[x_{NH_3} = \frac{1 - 0,679}{1 + 0,679} = \frac{0,321}{1,679} \approx 0,191\]Процентное содержание аммиака (объемные проценты) равно мольной доле, умноженной на 100%:
\[\text{Объемное содержание NH}_3 = 0,191 \cdot 100\% = 19,1\%\]Ответ:
а) Степень диссоциации аммиака при 400°C и 10,13·103 гПа составляет примерно 0,894 (или 89,4%).
б) Степень диссоциации аммиака при 400°C и 101,3·103 гПа составляет примерно 0,679 (или 67,9%). Процентное содержание аммиака в равновесной смеси составляет примерно 19,1%.