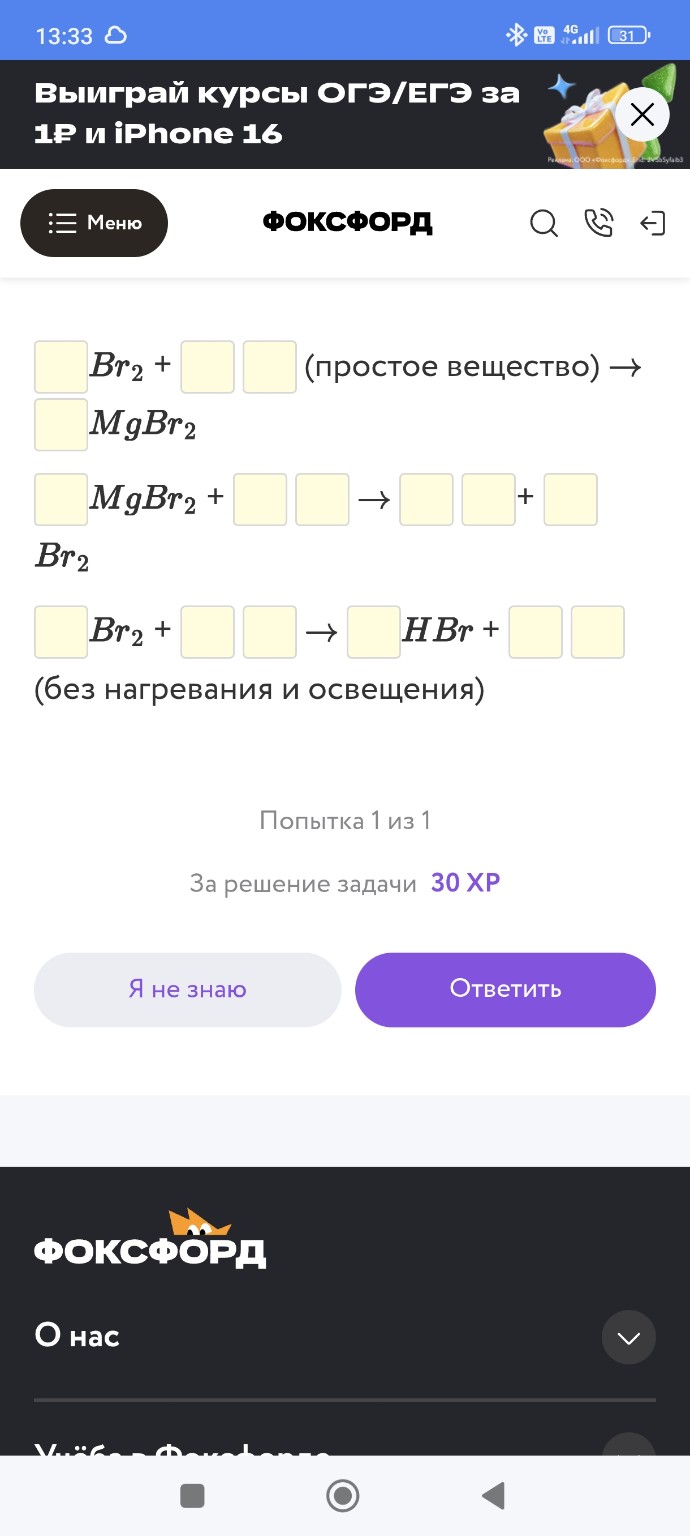
Дана схема превращений:
\(Br_2 \rightarrow MgBr_2 \xrightarrow{Cl_2} Br_2 \xrightarrow{H_2O} HBr \)
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Инструкция по заполнению полей ввода здесь (предполагается, что нужно вписать коэффициенты и формулы веществ).
Рассмотрим каждое превращение по порядку:
1. Превращение: \(Br_2 \rightarrow MgBr_2 \)
Чтобы получить бромид магния из брома, бром должен прореагировать с магнием (простым веществом).
Уравнение реакции:
\(Br_2 + Mg \rightarrow MgBr_2 \)
Коэффициенты: 1 перед \(Br_2\), 1 перед \(Mg\), 1 перед \(MgBr_2\). Поскольку коэффициент 1 не ставится, поля перед формулами останутся пустыми.
Заполнение полей:
_ \(Br_2\) + _ \(Mg\) (простое вещество) \(\rightarrow\) _ \(MgBr_2\)
2. Превращение: \(MgBr_2 \xrightarrow{Cl_2} Br_2 \)
Чтобы получить бром из бромида магния, нужно использовать более активный галоген, который вытеснит бром. Таким галогеном является хлор (\(Cl_2\)).
Уравнение реакции:
\(MgBr_2 + Cl_2 \rightarrow MgCl_2 + Br_2 \)
Коэффициенты: 1 перед \(MgBr_2\), 1 перед \(Cl_2\), 1 перед \(MgCl_2\), 1 перед \(Br_2\). Все коэффициенты равны 1.
Заполнение полей:
_ \(MgBr_2\) + _ \(Cl_2\) \(\rightarrow\) _ \(MgCl_2\) + _ \(Br_2\)
3. Превращение: \(Br_2 \xrightarrow{H_2O} HBr \)
Реакция брома с водой приводит к образованию бромоводородной кислоты (\(HBr\)) и бромноватистой кислоты (\(HBrO\)). Однако в схеме указано только образование \(HBr\). Это может означать, что реакция протекает в условиях, когда \(HBrO\) разлагается или восстанавливается, или же подразумевается общая реакция, где \(HBr\) является одним из продуктов.
Классическая реакция брома с водой:
\(Br_2 + H_2O \rightleftharpoons HBr + HBrO \)
Если же требуется получить только \(HBr\), то это может быть реакция брома с водородом, но в условии указано "без нагревания и освещения", что исключает прямую реакцию \(H_2 + Br_2\). Также, если речь идет о реакции с водой, то для получения только \(HBr\) из \(Br_2\) и \(H_2O\) без образования \(HBrO\) (или его последующего восстановления) требуется дополнительный восстановитель. Однако, если мы строго следуем схеме \(Br_2 \xrightarrow{H_2O} HBr\), то это может быть упрощенное представление или подразумевается дальнейшее превращение.
В контексте школьной химии, реакция брома с водой обычно записывается как образование двух кислот. Если же нужно получить только \(HBr\), то это может быть реакция брома с сероводородом или сульфитом, где бром выступает как окислитель, а вода присутствует как растворитель. Но в схеме указано только \(H_2O\).
Давайте предположим, что имеется в виду реакция, где бром восстанавливается до бромид-иона, а вода участвует в процессе. Однако, без дополнительного восстановителя, бром с водой дает \(HBr\) и \(HBrO\).
Если же задача подразумевает, что из \(Br_2\) и \(H_2O\) получается только \(HBr\), то это не совсем корректно с точки зрения стехиометрии без других реагентов. Возможно, подразумевается реакция, где \(HBrO\) затем восстанавливается, или же это упрощенная запись.
Наиболее распространенная реакция брома с водой:
\(Br_2 + H_2O \rightarrow HBr + HBrO \)
Если же нужно получить только \(HBr\), то это может быть реакция брома с восстановителем в водной среде. Например, с \(SO_2\):
\(Br_2 + SO_2 + 2H_2O \rightarrow 2HBr + H_2SO_4 \)
Но в схеме указано только \(H_2O\).
Если же мы должны получить \(HBr\) из \(Br_2\) и \(H_2O\) без нагревания и освещения, то это может быть реакция диспропорционирования брома в щелочной среде с последующим подкислением, но это уже сложнее, чем просто реакция с водой.
Давайте вернемся к прямой реакции брома с водой, как наиболее вероятному варианту в школьной программе, даже если в продуктах указан только \(HBr\). В таком случае, второй продукт будет \(HBrO\).
Уравнение реакции:
\(Br_2 + H_2O \rightarrow HBr + HBrO \)
Коэффициенты: 1 перед \(Br_2\), 1 перед \(H_2O\), 1 перед \(HBr\), 1 перед \(HBrO\). Все коэффициенты равны 1.
Заполнение полей:
_ \(Br_2\) + _ \(H_2O\) \(\rightarrow\) _ \(HBr\) + _ \(HBrO\)
(без нагревания и освещения)
Если же строго следовать тому, что в продуктах должен быть только \(HBr\), то это может быть ошибка в задании или подразумевается более сложный процесс, не укладывающийся в простую реакцию с водой.
Однако, если мы должны выбрать наиболее простой и прямой путь, то реакция брома с водой дает \(HBr\) и \(HBrO\). Если в задании просят только \(HBr\), то это может быть неполное уравнение или подразумевается, что \(HBrO\) не учитывается или разлагается.
В случае, если нужно получить только \(HBr\) из \(Br_2\) и \(H_2O\) без других реагентов, это невозможно без нарушения закона сохранения массы или без дополнительных условий/реагентов.
Предположим, что задача подразумевает, что \(HBr\) является основным продуктом, а \(HBrO\) может быть проигнорирован или подразумевается его дальнейшее превращение. В таком случае, коэффициенты будут 1.
Если же задача подразумевает, что \(HBr\) - единственный продукт, то это некорректно для реакции \(Br_2 + H_2O\).
Наиболее логичным для школьного уровня будет записать оба продукта.