Вот исправленное решение задачи, оформленное так, чтобы было удобно переписать в тетрадь школьнику.
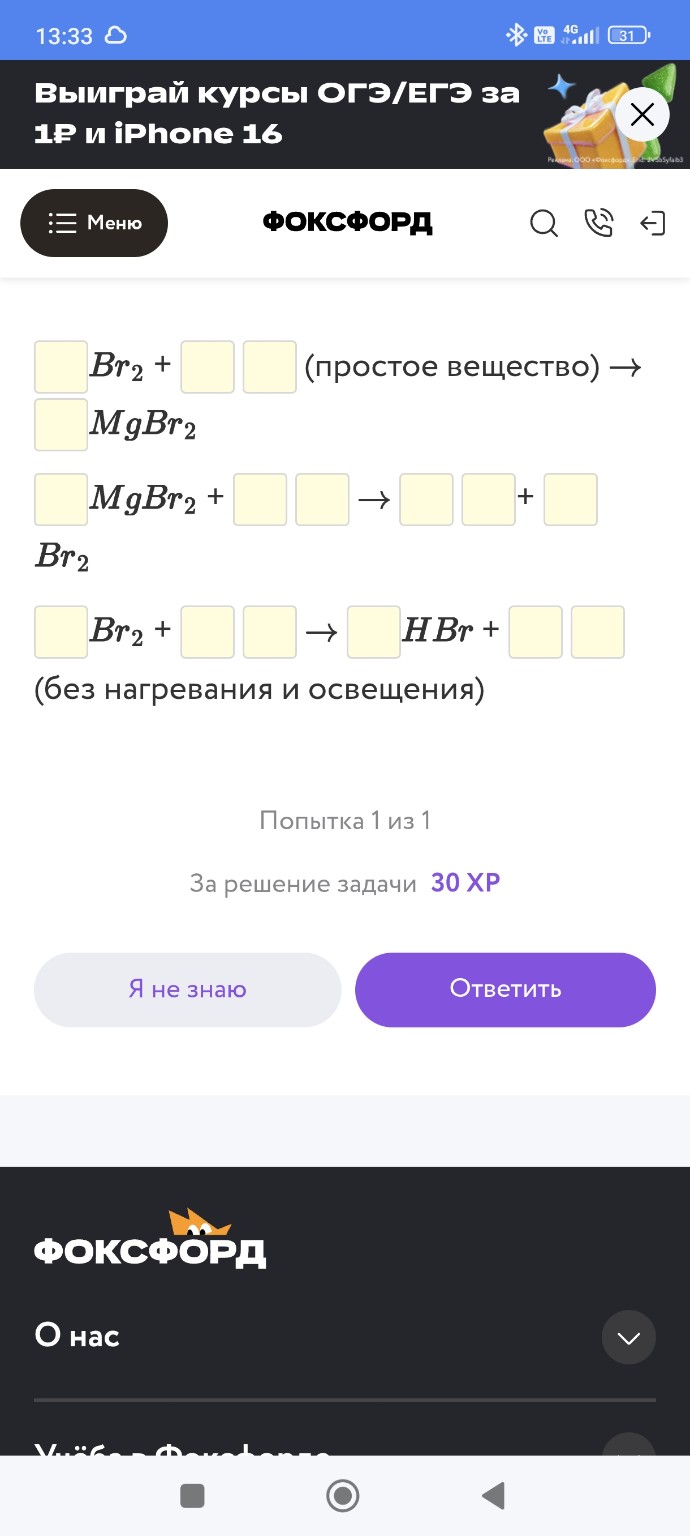
Дана схема превращений:
\(Br_2 \rightarrow MgBr_2 \xrightarrow{Cl_2} Br_2 \xrightarrow{H_2O} HBr \)
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Инструкция по заполнению полей ввода здесь (предполагается, что нужно вписать коэффициенты и формулы веществ).
Рассмотрим каждое превращение по порядку:
1. Превращение: \(Br_2 \rightarrow MgBr_2 \)
Чтобы получить бромид магния из брома, бром должен прореагировать с магнием (простым веществом).
Уравнение реакции:
\(Br_2 + Mg \rightarrow MgBr_2 \)
Коэффициенты: 1 перед \(Br_2\), 1 перед \(Mg\), 1 перед \(MgBr_2\). Поскольку коэффициент 1 не ставится, поля перед формулами останутся пустыми.
Заполнение полей:
_ \(Br_2\) + _ \(Mg\) (простое вещество) \(\rightarrow\) _ \(MgBr_2\)
2. Превращение: \(MgBr_2 \xrightarrow{Cl_2} Br_2 \)
Чтобы получить бром из бромида магния, нужно использовать более активный галоген, который вытеснит бром. Таким галогеном является хлор (\(Cl_2\)).
Уравнение реакции:
\(MgBr_2 + Cl_2 \rightarrow MgCl_2 + Br_2 \)
Коэффициенты: 1 перед \(MgBr_2\), 1 перед \(Cl_2\), 1 перед \(MgCl_2\), 1 перед \(Br_2\). Все коэффициенты равны 1.
Заполнение полей:
_ \(MgBr_2\) + _ \(Cl_2\) \(\rightarrow\) _ \(MgCl_2\) + _ \(Br_2\)
3. Превращение: \(Br_2 \xrightarrow{H_2O} HBr \)
Реакция брома с водой приводит к образованию бромоводородной кислоты (\(HBr\)) и бромноватистой кислоты (\(HBrO\)). Если в схеме указано только \(HBr\) как продукт, это может быть упрощение или подразумевается, что \(HBrO\) не является целевым продуктом. Однако, если мы должны записать полную реакцию брома с водой, то она выглядит так:
\(Br_2 + H_2O \rightleftharpoons HBr + HBrO \)
Если же задача строго требует получения только \(HBr\) из \(Br_2\) и \(H_2O\) без нагревания и освещения, то это может быть реакция с дополнительным восстановителем, который не указан в схеме. Например, с сернистым газом (\(SO_2\)):
\(Br_2 + SO_2 + 2H_2O \rightarrow 2HBr + H_2SO_4 \)
Но поскольку в схеме указано только \(H_2O\), и условие "без нагревания и освещения" исключает прямую реакцию с водородом, наиболее вероятным является, что в задании допущено упрощение, и подразумевается, что из продуктов реакции брома с водой нас интересует именно \(HBr\).
В школьной практике, если из \(Br_2\) и \(H_2O\) нужно получить только \(HBr\), это часто подразумевает, что \(HBrO\) либо не учитывается, либо его дальнейшее превращение не рассматривается в рамках данной задачи. Однако, для полноты и корректности, если нет других указаний, следует записывать оба продукта.
Если же мы должны строго следовать тому, что в продуктах должен быть только \(HBr\), то это может быть реакция брома с восстановителем в водной среде. Но так как восстановитель не указан, это затрудняет однозначный ответ.
Давайте предположим, что задача подразумевает реакцию, где бром восстанавливается до бромоводорода, а вода является средой. В таком случае, если бы был указан восстановитель, например, \(SO_2\), то реакция была бы:
\(Br_2 + SO_2 + 2H_2O \rightarrow 2HBr + H_2SO_4 \)
Если же мы должны использовать только \(Br_2\) и \(H_2O\), то полная реакция:
\(Br_2 + H_2O \rightarrow HBr + HBrO \)
Если же в задании подразумевается, что \(HBrO\) не является целевым продуктом и его можно опустить, то это будет упрощение. Но для химической корректности, оба продукта образуются.
В случае, если нужно заполнить поля, и в продуктах уже стоит \(HBr\), то второе поле для продукта, скорее всего, предназначено для \(HBrO\).
Уравнение реакции:
\(Br_2 + H_2O \rightarrow HBr + HBrO \)
Коэффициенты: 1 перед \(Br_2\), 1 перед \(H_2O\), 1 перед \(HBr\), 1 перед \(HBrO\). Все коэффициенты равны 1.
Заполнение полей:
_ \(Br_2\) + _ \(H_2O\) \(\rightarrow\) _ \(HBr\) + _ \(HBrO\)
(без нагревания и освещения)