Хорошо, давайте решим эту задачу.
Задача состоит в том, чтобы уравнять окислительно-восстановительную реакцию и указать коэффициенты.
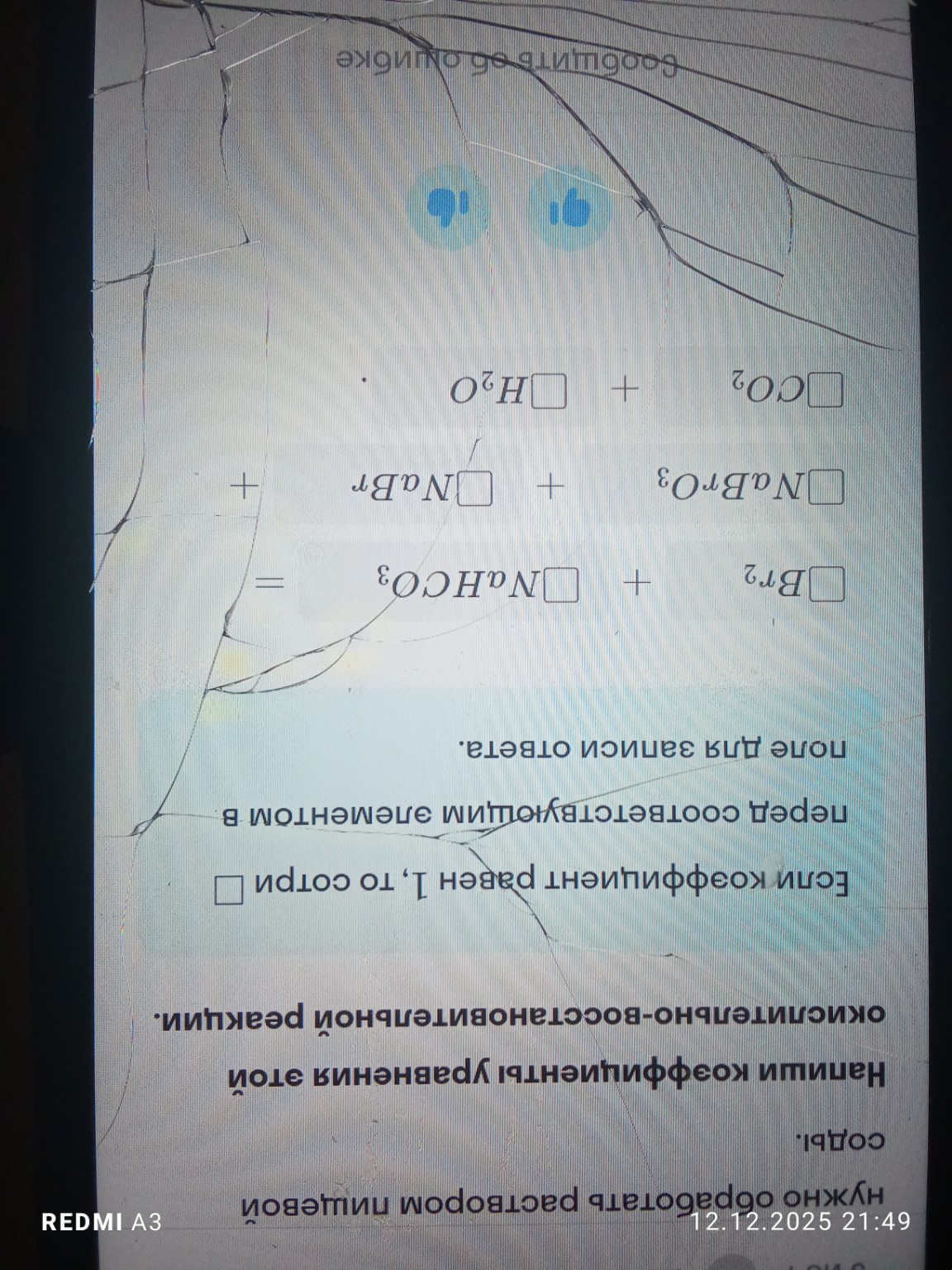
Дана следующая схема реакции:
\[ \text{Br}_2 + \text{NaHCO}_3 = \text{NaBrO}_3 + \text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
Для уравнивания окислительно-восстановительных реакций используем метод электронного баланса.
1. Определим степени окисления элементов, которые меняют свою степень окисления.
* В \(\text{Br}_2\), бром имеет степень окисления 0.
* В \(\text{NaBrO}_3\), кислород имеет степень окисления -2, натрий +1. Пусть степень окисления брома будет \(x\). Тогда \(+1 + x + 3 \cdot (-2) = 0 \Rightarrow 1 + x - 6 = 0 \Rightarrow x = +5\).
* В \(\text{NaBr}\), натрий +1. Пусть степень окисления брома будет \(y\). Тогда \(+1 + y = 0 \Rightarrow y = -1\).
2. Запишем процессы окисления и восстановления.
Бром в \(\text{Br}_2\) (степень окисления 0) переходит в бром в \(\text{NaBrO}_3\) (степень окисления +5) и в бром в \(\text{NaBr}\) (степень окисления -1). Это диспропорционирование (самоокисление-самовосстановление).
* Процесс окисления (повышение степени окисления):
\[ \text{Br}_2^0 \rightarrow 2\text{Br}^{+5} \]
Каждый атом брома отдает 5 электронов. Так как в молекуле \(\text{Br}_2\) два атома брома, то:
\[ \text{Br}_2^0 - 10\text{e}^- \rightarrow 2\text{Br}^{+5} \]
(Бром является восстановителем)
* Процесс восстановления (понижение степени окисления):
\[ \text{Br}_2^0 \rightarrow 2\text{Br}^{-1} \]
Каждый атом брома принимает 1 электрон. Так как в молекуле \(\text{Br}_2\) два атома брома, то:
\[ \text{Br}_2^0 + 2\text{e}^- \rightarrow 2\text{Br}^{-1} \]
(Бром является окислителем)
3. Найдем наименьшее общее кратное (НОК) для числа отданных и принятых электронов.
НОК для 10 и 2 равно 10.
4. Расставим коэффициенты перед полуреакциями так, чтобы число отданных и принятых электронов было одинаковым.
* Для окисления: \(\text{Br}_2^0 - 10\text{e}^- \rightarrow 2\text{Br}^{+5}\) (коэффициент 1)
* Для восстановления: \(\text{Br}_2^0 + 2\text{e}^- \rightarrow 2\text{Br}^{-1}\) (коэффициент 5)
5. Сложим полуреакции, учитывая коэффициенты:
\[ 1 \cdot (\text{Br}_2^0 - 10\text{e}^- \rightarrow 2\text{Br}^{+5}) \]
\[ 5 \cdot (\text{Br}_2^0 + 2\text{e}^- \rightarrow 2\text{Br}^{-1}) \]
Суммируем:
\[ \text{Br}_2^0 + 5\text{Br}_2^0 \rightarrow 2\text{Br}^{+5} + 10\text{Br}^{-1} \]
\[ 6\text{Br}_2^0 \rightarrow 2\text{Br}^{+5} + 10\text{Br}^{-1} \]
Разделим все коэффициенты на 2 для упрощения:
\[ 3\text{Br}_2^0 \rightarrow \text{Br}^{+5} + 5\text{Br}^{-1} \]
6. Перенесем эти коэффициенты в исходное уравнение.
* Перед \(\text{Br}_2\) ставим 3.
* Перед \(\text{NaBrO}_3\) (где бром +5) ставим 1 (подразумевается, если не указано).
* Перед \(\text{NaBr}\) (где бром -1) ставим 5.
Получаем:
\[ 3\text{Br}_2 + \text{NaHCO}_3 = 1\text{NaBrO}_3 + 5\text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
7. Уравняем остальные элементы методом подбора.
* Натрий (Na):
Справа: 1 (в \(\text{NaBrO}_3\)) + 5 (в \(\text{NaBr}\)) = 6 атомов Na.
Слева: в \(\text{NaHCO}_3\) 1 атом Na. Чтобы уравнять, ставим коэффициент 6 перед \(\text{NaHCO}_3\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
* Углерод (C):
Слева: 6 атомов C (в \(6\text{NaHCO}_3\)).
Справа: в \(\text{CO}_2\) 1 атом C. Чтобы уравнять, ставим коэффициент 6 перед \(\text{CO}_2\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + \text{H}_2\text{O} \]
* Водород (H):
Слева: 6 атомов H (в \(6\text{NaHCO}_3\)).
Справа: в \(\text{H}_2\text{O}\) 2 атома H. Чтобы уравнять, ставим коэффициент 3 перед \(\text{H}_2\text{O}\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + 3\text{H}_2\text{O} \]
* Кислород (O): Проверим кислород.
Слева: \(6 \cdot 3 = 18\) атомов O (в \(6\text{NaHCO}_3\)).
Справа: \(3\) (в \(\text{NaBrO}_3\)) + \(6 \cdot 2\) (в \(6\text{CO}_2\)) + \(3\) (в \(3\text{H}_2\text{O}\)) = \(3 + 12 + 3 = 18\) атомов O.
Кислород уравнен.
Окончательное уравненное уравнение реакции:
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + 3\text{H}_2\text{O} \]
Теперь ответим на вопросы:
"Напиши коэффициенты уравнения этой окислительно-восстановительной реакции. Если коэффициент равен 1, то сотри поле для записи ответа."
Коэффициенты перед соответствующими элементами:
* Перед \(\text{Br}_2\): 3
* Перед \(\text{NaHCO}_3\): 6
* Перед \(\text{NaBrO}_3\): 1
* Перед \(\text{NaBr}\): 5
* Перед \(\text{CO}_2\): 6
* Перед \(\text{H}_2\text{O}\): 3
В тетрадь можно переписать так:
Задача: Уравнять окислительно-восстановительную реакцию и указать коэффициенты.
Дано: Схема реакции:
\[ \text{Br}_2 + \text{NaHCO}_3 = \text{NaBrO}_3 + \text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
Решение:
1. Определим степени окисления элементов, которые меняют свою степень окисления:
- В \(\text{Br}_2\): \(\text{Br}^0\)
- В \(\text{NaBrO}_3\): \(\text{Na}^{+1}\text{Br}^{+5}\text{O}_3^{-2}\)
- В \(\text{NaBr}\): \(\text{Na}^{+1}\text{Br}^{-1}\)
2. Запишем процессы окисления и восстановления (электронный баланс):
- Окисление: Бром повышает степень окисления от 0 до +5.
\[ \text{Br}_2^0 - 10\text{e}^- \rightarrow 2\text{Br}^{+5} \]
(Каждый атом брома отдает 5 электронов, всего 2 атома, значит \(2 \times 5 = 10\) электронов)
- Восстановление: Бром понижает степень окисления от 0 до -1.
\[ \text{Br}_2^0 + 2\text{e}^- \rightarrow 2\text{Br}^{-1} \]
(Каждый атом брома принимает 1 электрон, всего 2 атома, значит \(2 \times 1 = 2\) электрона)
3. Найдем наименьшее общее кратное (НОК) для числа отданных и принятых электронов:
НОК(10, 2) = 10
4. Расставим коэффициенты перед полуреакциями:
- Для окисления: \(\text{Br}_2^0 - 10\text{e}^- \rightarrow 2\text{Br}^{+5}\) | 1
- Для восстановления: \(\text{Br}_2^0 + 2\text{e}^- \rightarrow 2\text{Br}^{-1}\) | 5
5. Сложим полуреакции:
\[ 1 \cdot \text{Br}_2^0 + 5 \cdot \text{Br}_2^0 \rightarrow 1 \cdot 2\text{Br}^{+5} + 5 \cdot 2\text{Br}^{-1} \]
\[ 6\text{Br}_2^0 \rightarrow 2\text{Br}^{+5} + 10\text{Br}^{-1} \]
Разделим все коэффициенты на 2 для упрощения:
\[ 3\text{Br}_2^0 \rightarrow \text{Br}^{+5} + 5\text{Br}^{-1} \]
6. Перенесем эти коэффициенты в исходное уравнение:
- Перед \(\text{Br}_2\) ставим 3.
- Перед \(\text{NaBrO}_3\) (где бром +5) ставим 1.
- Перед \(\text{NaBr}\) (где бром -1) ставим 5.
Получаем:
\[ 3\text{Br}_2 + \text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
7. Уравняем остальные элементы методом подбора:
- Натрий (Na): Справа \(1 + 5 = 6\) атомов Na. Слева в \(\text{NaHCO}_3\) 1 атом Na. Ставим коэффициент 6 перед \(\text{NaHCO}_3\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + \text{CO}_2 + \text{H}_2\text{O} \]
- Углерод (C): Слева 6 атомов C (в \(6\text{NaHCO}_3\)). Справа в \(\text{CO}_2\) 1 атом C. Ставим коэффициент 6 перед \(\text{CO}_2\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + \text{H}_2\text{O} \]
- Водород (H): Слева 6 атомов H (в \(6\text{NaHCO}_3\)). Справа в \(\text{H}_2\text{O}\) 2 атома H. Ставим коэффициент 3 перед \(\text{H}_2\text{O}\).
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + 3\text{H}_2\text{O} \]
- Кислород (O): Проверим. Слева \(6 \times 3 = 18\) атомов O. Справа \(3 + (6 \times 2) + 3 = 3 + 12 + 3 = 18\) атомов O. Кислород уравнен.
Окончательное уравненное уравнение реакции:
\[ 3\text{Br}_2 + 6\text{NaHCO}_3 = \text{NaBrO}_3 + 5\text{NaBr} + 6\text{CO}_2 + 3\text{H}_2\text{O} \]
Коэффициенты:
- Перед \(\text{Br}_2\): 3
- Перед \(\text{NaHCO}_3\): 6
- Перед \(\text{NaBrO}_3\): 1
- Перед \(\text{NaBr}\): 5
- Перед \(\text{CO}_2\): 6
- Перед \(\text{H}_2\text{O}\): 3