| Изопроцесс | Выражение |
| Адиабатический | \( \delta A = -dU \) |
| Изобарический | \( \delta Q = dH \) |
| Политропный | \( \delta Q = CdT \) |
| Изохорический | \( \delta Q = dU \) |
| Изотермический | \( \delta Q = \delta A \) |
school
Общие знания
verified
Решено AI
Решение задачи по термодинамике: сопоставление изопроцессов и первого начала
help_outline
Условие задачи
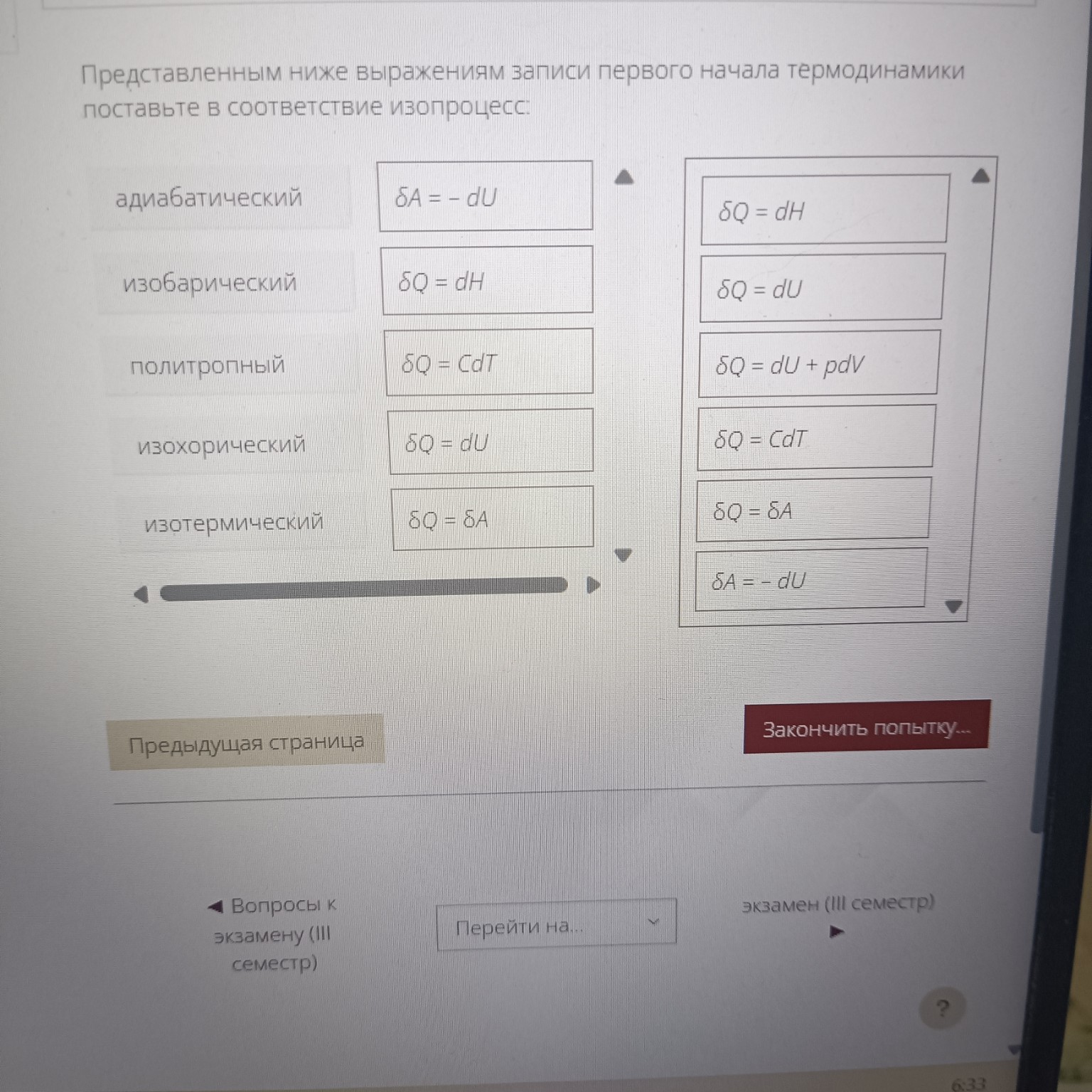
lightbulb
Краткий ответ
В адиабатическом процессе теплообмен отсутствует, поэтому работа совершается за счет изменения внутренней энергии. В изобарическом процессе давление остается постоянным.
Подробное решение
Хорошо, давайте разберем это задание по термодинамике. Нам нужно сопоставить изопроцессы с соответствующими выражениями первого начала термодинамики.
Первое начало термодинамики в общем виде выглядит так:
\[ \delta Q = dU + \delta A \]
где:
* \( \delta Q \) — количество теплоты, переданное системе.
* \( dU \) — изменение внутренней энергии системы.
* \( \delta A \) — работа, совершаемая системой.
Давайте рассмотрим каждый изопроцесс:
1. Адиабатический процесс:
Это процесс, который протекает без теплообмена с окружающей средой. То есть, \( \delta Q = 0 \).
Подставляем это в первое начало термодинамики:
\[ 0 = dU + \delta A \]
Отсюда:
\[ \delta A = -dU \]
или
\[ dU = -\delta A \]
2. Изобарический процесс:
Это процесс, протекающий при постоянном давлении (\( P = \text{const} \)).
Работа, совершаемая системой при постоянном давлении, равна \( \delta A = P dV \).
Тогда первое начало термодинамики:
\[ \delta Q = dU + P dV \]
Мы также знаем, что энтальпия \( H \) определяется как \( H = U + PV \).
Изменение энтальпии: \( dH = dU + P dV + V dP \).
Поскольку \( P = \text{const} \), то \( dP = 0 \).
Следовательно, \( dH = dU + P dV \).
Таким образом, для изобарического процесса:
\[ \delta Q = dH \]
3. Политропный процесс:
Это обобщенный процесс, который описывается уравнением \( P V^n = \text{const} \), где \( n \) — показатель политропы.
Для политропного процесса количество теплоты можно выразить через изменение температуры:
\[ \delta Q = C_n dT \]
где \( C_n \) — политропная теплоемкость.
4. Изохорический процесс:
Это процесс, протекающий при постоянном объеме (\( V = \text{const} \)).
При постоянном объеме работа, совершаемая системой, равна нулю (\( \delta A = P dV = 0 \), так как \( dV = 0 \)).
Подставляем это в первое начало термодинамики:
\[ \delta Q = dU + 0 \]
\[ \delta Q = dU \]
5. Изотермический процесс:
Это процесс, протекающий при постоянной температуре (\( T = \text{const} \)).
Для идеального газа внутренняя энергия зависит только от температуры, поэтому при постоянной температуре изменение внутренней энергии равно нулю (\( dU = 0 \)).
Подставляем это в первое начало термодинамики:
\[ \delta Q = 0 + \delta A \]
\[ \delta Q = \delta A \]
Теперь сопоставим выражения:
* Адиабатический: \( \delta A = -dU \)
* Изобарический: \( \delta Q = dH \)
* Политропный: \( \delta Q = C_n dT \) (в данном случае \( C_n \) обозначено как \( C \))
* Изохорический: \( \delta Q = dU \)
* Изотермический: \( \delta Q = \delta A \)
Вот как это будет выглядеть в таблице: