Задача:
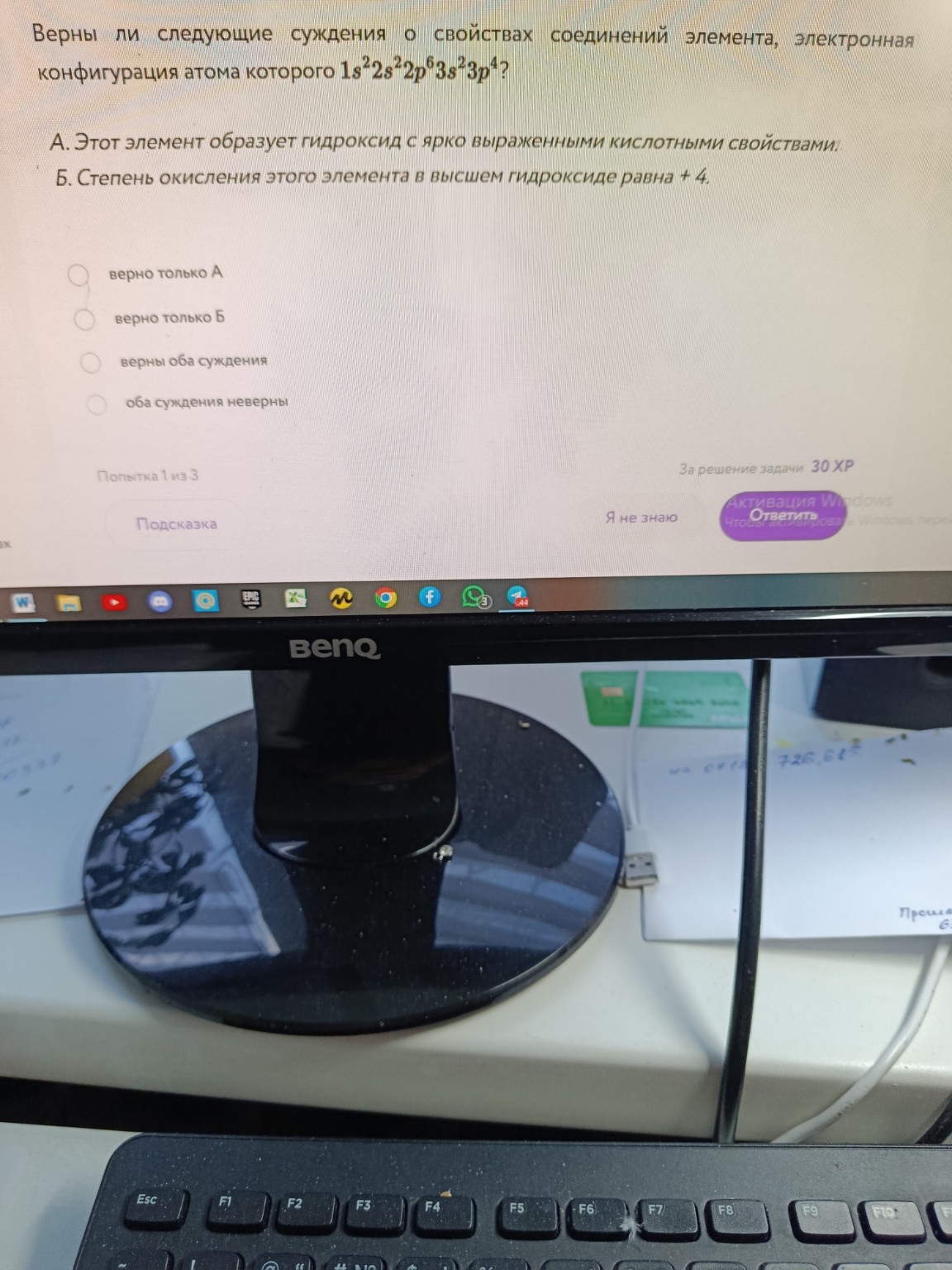
Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого \(1s^22s^22p^63s^23p^4\)?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна +4.
Варианты ответа:
- верно только А
- верно только Б
- верны оба суждения
- оба суждения неверны
Решение:
1. Определим элемент по электронной конфигурации:
- Электронная конфигурация атома: \(1s^22s^22p^63s^23p^4\).
- Сумма электронов: \(2+2+6+2+4 = 16\). Это атомный номер элемента.
- Элемент с атомным номером 16 – это Сера (S).
- Внешний электронный слой: \(3s^23p^4\). Это означает, что элемент находится в 3-м периоде и VI группе (главной подгруппе), так как \(2+4=6\) валентных электронов.
2. Проверим суждение А: "Этот элемент образует гидроксид с ярко выраженными кислотными свойствами."
- Сера (S) – это неметалл.
- Неметаллы образуют кислотные оксиды и соответствующие им кислоты (гидроксиды с кислотными свойствами).
- Высший оксид серы – \(SO_3\). Соответствующий ему гидроксид – серная кислота (\(H_2SO_4\)).
- Серная кислота является сильной кислотой, то есть обладает ярко выраженными кислотными свойствами.
- Вывод по суждению А: Суждение А верно.
3. Проверим суждение Б: "Степень окисления этого элемента в высшем гидроксиде равна +4."
- Высшая степень окисления элемента в главной подгруппе обычно равна номеру группы.
- Сера находится в VI группе, поэтому её высшая степень окисления равна +6.
- Высший гидроксид серы – серная кислота (\(H_2SO_4\)).
- Определим степень окисления серы в \(H_2SO_4\):
- Степень окисления водорода (H) = +1.
- Степень окисления кислорода (O) = -2.
- Пусть степень окисления серы (S) = x.
- Тогда: \(2 \cdot (+1) + x + 4 \cdot (-2) = 0\)
- \(2 + x - 8 = 0\)
- \(x - 6 = 0\)
- \(x = +6\)
- Таким образом, степень окисления серы в высшем гидроксиде (\(H_2SO_4\)) равна +6, а не +4.
- Вывод по суждению Б: Суждение Б неверно.
Общий вывод:
- Суждение А верно.
- Суждение Б неверно.
Ответ:
верно только А