Текст для справки:
Кислород образует две аллотропные модификации – кислород \(O_2\) и озон \(O_3\).
Молекула озона угловая, полярная, образована тремя атомами кислорода. В молекуле две равноценные химические связи длиной 1,272 Å, кратность которых принимается равной 1,5.
Озон содержится в верхних слоях атмосферы и защищает Землю от ультрафиолетового излучения. В нижних слоях атмосферы озон образуется при грозовых разрядах. Те, кто любят гулять после грозы хорошо знают специфический запах озона – это запах свежести.
Обнаружить озон можно с помощью влажной иодкрахмальной бумажки и зажигалки с пьезоподжигом. Образующийся при электрическом разряде озон вытесняет иод, наблюдается посинение бумажки.
Озон – неустойчивая аллотропная модификация кислорода, разлагается под действием ультрафиолета, оксидов азота, атомарного хлора, фреонов и некоторых других веществ. Озон является более сильным окислителем чем кислород, уже при обычных условиях он окисляет такие малоактивные металлы как серебро и ртуть с образованием оксидов и \(O_2\) молекулярного кислорода.
Часть 1: Выберите изображение, наиболее точно иллюстрирующее строение молекулы озона:
Изображения:
A: Треугольник из атомов O с одинарными связями.
Б: Угловая молекула из атомов O с одной одинарной и одной двойной связью (или резонансная структура).
В: Линейная молекула O=O=O.
Решение Части 1:
- В тексте указано: "Молекула озона угловая, полярная, образована тремя атомами кислорода. В молекуле две равноценные химические связи длиной 1,272 Å, кратность которых принимается равной 1,5."
- Изображение А показывает треугольную молекулу, что не соответствует "угловой".
- Изображение В показывает линейную молекулу, что не соответствует "угловой".
- Изображение Б показывает угловую молекулу. Указание на "равноценные химические связи длиной 1,272 Å, кратность которых принимается равной 1,5" говорит о резонансной структуре, где связи не являются чисто одинарными или чисто двойными, а имеют промежуточный характер. Изображение Б с одной одинарной и одной двойной связью является одной из резонансных структур, которые в совокупности описывают реальное строение с полуторными связями.
- Вывод: Наиболее точно иллюстрирует строение молекулы озона изображение Б.
Часть 2: Кислород и озон отличаются ... (выберите все подходящие варианты ответов)
Варианты:
- физическими свойствами
- качественным составом молекулы
- типом кристаллической решётки в твёрдом агрегатном состоянии
- строением молекулы
- химическими свойствами
Решение Части 2:
- Физическими свойствами: Да, отличаются. Например, озон имеет специфический запах, кислород – нет. Озон синий в жидком состоянии, кислород – бледно-голубой. Озон более плотный.
- Качественным составом молекулы: Нет, не отличаются. И кислород (\(O_2\)), и озон (\(O_3\)) состоят только из атомов кислорода. Они являются аллотропными модификациями одного элемента.
- Типом кристаллической решётки в твёрдом агрегатном состоянии: Да, отличаются. Поскольку у них разное строение молекул (\(O_2\) и \(O_3\)), то и молекулярные кристаллические решётки, образуемые этими молекулами в твёрдом состоянии, будут отличаться.
- Строением молекулы: Да, отличаются. Молекула кислорода \(O_2\) – линейная, двухатомная. Молекула озона \(O_3\) – угловая, трёхатомная.
- Химическими свойствами: Да, отличаются. В тексте указано, что "Озон является более сильным окислителем чем кислород". Это прямое указание на различие в химических свойствах.
Вывод: Кислород и озон отличаются физическими свойствами, типом кристаллической решётки в твёрдом агрегатном состоянии, строением молекулы, химическими свойствами.
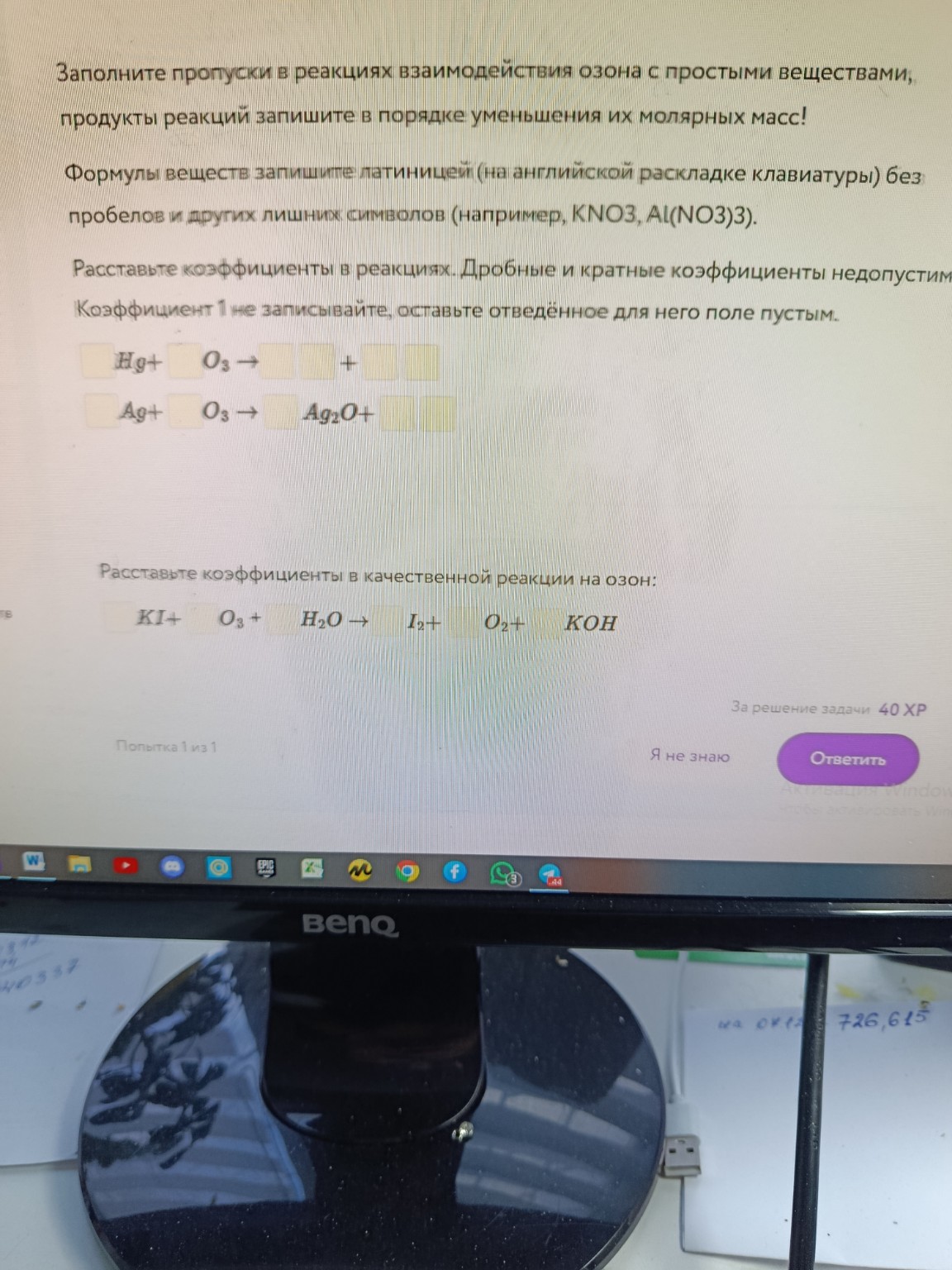
Часть 3: Заполните пропуски в реакциях взаимодействия озона с простыми веществами, продукты реакций запишите в порядке уменьшения их молярных масс! Расставьте коэффициенты в реакциях. Дробные и кратные коэффициенты недопустимы. Коэффициент 1 не записывайте, оставьте отведённое для него поле пустым.
Реакции:
1. \(Hg + O_3 \rightarrow \text{___} + \text{___}\)
2. \(Ag + O_3 \rightarrow Ag_2O + \text{___}\)
Решение Части 3:
Из текста известно, что "Озон является более сильным окислителем чем кислород, уже при обычных условиях он окисляет такие малоактивные металлы как серебро и ртуть с образованием оксидов и \(O_2\) молекулярного кислорода."
1. Реакция ртути с озоном:
Ртуть (Hg) окисляется озоном до оксида ртути (II) (\(HgO\)), при этом выделяется молекулярный кислород (\(O_2\)).
Неуравненное уравнение: \(Hg + O_3 \rightarrow HgO + O_2\)
Уравняем реакцию:
- Атомы Hg: 1 слева, 1 справа.
- Атомы O: 3 слева, \(1+2=3\) справа.
Уравненное уравнение: \(Hg + O_3 \rightarrow HgO + O_2\)
Продукты: \(HgO\) и \(O_2\).
Молярные массы продуктов:
- \(M(HgO) = M(Hg) + M(O) = 200,59 + 16 = 216,59 \text{ г/моль}\)
- \(M(O_2) = 2 \times M(O) = 2 \times 16 = 32 \text{ г/моль}\)
В порядке уменьшения молярных масс: \(HgO\), \(O_2\).
Заполнение: \(Hg + O_3 \rightarrow \text{HgO} + \text{O2}\)
2. Реакция серебра с озоном:
Серебро (Ag) окисляется озоном до оксида серебра (I) (\(Ag_2O\)), при этом также выделяется молекулярный кислород (\(O_2\)).
Неуравненное уравнение: \(Ag + O_3 \rightarrow Ag_2O + O_2\)
Уравняем реакцию:
- Атомы Ag: 1 слева, 2 справа. Поставим 2 перед Ag: \(2Ag + O_3 \rightarrow Ag_2O + O_2\)
- Атомы O: 3 слева, \(1+2=3\) справа.
Уравненное уравнение: \(2Ag + O_3 \rightarrow Ag_2O + O_2\)
Продукт, который нужно вписать: \(O_2\).
Заполнение: \(2Ag + O_3 \rightarrow Ag_2O + \text{O2}\)
Часть 4: Расставьте коэффициенты в качественной реакции на озон:
\(KI + O_3 + H_2O \rightarrow I_2 + O_2 + KOH\)
Решение Части 4:
Это окислительно-восстановительная реакция. Озон (\(O_3\)) окисляет иодид-ионы (\(I^-\)) до молекулярного иода (\(I_2\)).
Изменение степеней окисления:
- \(I^{-1} \rightarrow I_2^0\) (иод окисляется)
- \(O_3^0 \rightarrow O_2^0\) и \(O^{-2}\) (кислород в озоне восстанавливается)
Метод электронного баланса:
Окисление иода:
\[ 2I^{-1} - 2e^- \rightarrow I_2^0 \]Восстановление озона (один атом кислорода в озоне восстанавливается до \(O^{-2}\) в \(KOH\), остальные два атома образуют \(O_2\)):
\[ O_3^0 + 2e^- \rightarrow O_2^0 + O^{-2} \]Или, если рассматривать озон как окислитель, который распадается на \(O_2\) и атомарный кислород, который затем восстанавливается:
\[ O_3 + H_2O + 2e^- \rightarrow O_2 + 2OH^- \]В данном случае, \(O_3\) восстанавливается, а \(I^-\) окисляется.
Коэффициенты для электронного баланса: 1 для иода и 1 для озона.
Теперь расставим коэффициенты в уравнении:
\(KI + O_3 + H_2O \rightarrow I_2 + O_2 + KOH\)
1. Уравняем иод: \(2KI + O_3 + H_2O \rightarrow I_2 + O_2 + KOH\)
2. Уравняем калий: \(2KI + O_3 + H_2O \rightarrow I_2 + O_2 + 2KOH\)
3. Проверим водород: 2 атома H слева (\(H_2O\)), 2 атома H справа (\(2KOH\)). Водород уравнен.
4. Проверим кислород:
- Слева: 3 (из \(O_3\)) + 1 (из \(H_2O\)) = 4 атома O.
- Справа: 2 (из \(O_2\)) + 2 (из \(2KOH\)) = 4 атома O.
Уравненное уравнение: \(2KI + O_3 + H_2O \rightarrow I_2 + O_2 + 2KOH\)
Коэффициенты:
- KI: 2
- O3: (1, не записываем)
- H2O: (1, не записываем)
- I2: (1, не записываем)
- O2: (1, не записываем)
- KOH: 2