schoolФизика
verifiedРешено AI
Решение задачи B21: Определение молярной массы и числа степеней свободы газа
help_outlineУсловие задачи
lightbulbКраткий ответ
Молярная масса газа определяется через соотношение Майера и универсальную газовую постоянную. Число степеней свободы находится исходя из рассчитанных молярных теплоемкостей.
Подробное решение
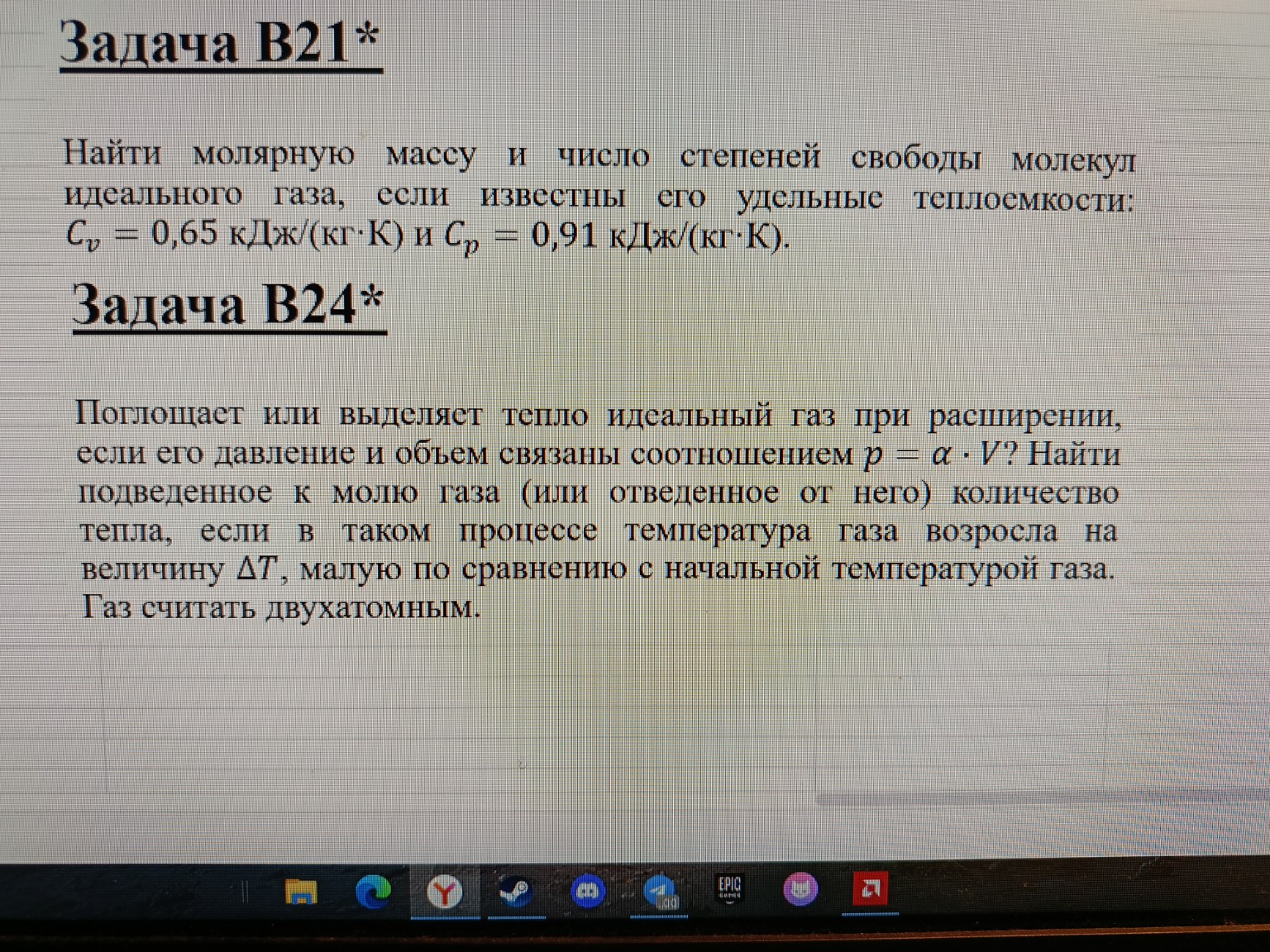
Задача B21*
Найти молярную массу и число степеней свободы молекул идеального газа, если известны его удельные теплоемкости: \(c_V = 0,65 \text{ кДж/(кг}\cdot\text{К)}\) и \(c_p = 0,91 \text{ кДж/(кг}\cdot\text{К)}\).
Решение:
Дано:
\(c_V = 0,65 \text{ кДж/(кг}\cdot\text{К)} = 650 \text{ Дж/(кг}\cdot\text{К)}\)
\(c_p = 0,91 \text{ кДж/(кг}\cdot\text{К)} = 910 \text{ Дж/(кг}\cdot\text{К)}\)
Универсальная газовая постоянная \(R = 8,314 \text{ Дж/(моль}\cdot\text{К)}\)
1. Найдем молярную массу газа.
Для идеального газа справедливо соотношение Майера, которое связывает молярные теплоемкости \(C_p\) и \(C_V\):
\[C_p - C_V = R\]
Удельные теплоемкости \(c_p\) и \(c_V\) связаны с молярными теплоемкостями \(C_p\) и \(C_V\) через молярную массу \(M\):
\[C_p = c_p \cdot M\]
\[C_V = c_V \cdot M\]
Подставим эти выражения в соотношение Майера:
\[c_p \cdot M - c_V \cdot M = R\]
Вынесем \(M\) за скобки:
\[M(c_p - c_V) = R\]
Отсюда выразим молярную массу \(M\):
\[M = \frac{R}{c_p - c_V}\]
Подставим числовые значения:
\[M = \frac{8,314 \text{ Дж/(моль}\cdot\text{К)}}{910 \text{ Дж/(кг}\cdot\text{К)} - 650 \text{ Дж/(кг}\cdot\text{К)}}\]
\[M = \frac{8,314 \text{ Дж/(моль}\cdot\text{К)}}{260 \text{ Дж/(кг}\cdot\text{К)}}\]
\[M \approx 0,03197 \text{ кг/моль}\]
Округлим до более удобного значения:
\[M \approx 0,032 \text{ кг/моль} = 32 \text{ г/моль}\]
Это значение молярной массы соответствует кислороду (\(\text{O}_2\)).
2. Найдем число степеней свободы молекул газа.
Для идеального газа молярная теплоемкость при постоянном объеме \(C_V\) связана с числом степеней свободы \(i\) формулой:
\[C_V = \frac{i}{2} R\]
Отсюда выразим число степеней свободы \(i\):
\[i = \frac{2 C_V}{R}\]
Мы знаем, что \(C_V = c_V \cdot M\). Подставим это:
\[i = \frac{2 \cdot c_V \cdot M}{R}\]
Подставим числовые значения:
\[i = \frac{2 \cdot 650 \text{ Дж/(кг}\cdot\text{К)} \cdot 0,03197 \text{ кг/моль}}{8,314 \text{ Дж/(моль}\cdot\text{К)}}\]
\[i \approx \frac{41,561}{8,314} \approx 5\]
Число степеней свободы должно быть целым числом, поэтому округляем до 5.
Также можно использовать отношение теплоемкостей (показатель адиабаты) \(\gamma\):
\[\gamma = \frac{C_p}{C_V} = \frac{c_p \cdot M}{c_V \cdot M} = \frac{c_p}{c_V}\]
\[\gamma = \frac{910 \text{ Дж/(кг}\cdot\text{К)}}{650 \text{ Дж/(кг}\cdot\text{К)}} = 1,4\]
Для идеального газа показатель адиабаты \(\gamma\) связан с числом степеней свободы \(i\) формулой:
\[\gamma = 1 + \frac{2}{i}\]
Выразим \(i\):
\[\frac{2}{i} = \gamma - 1\]
\[i = \frac{2}{\gamma - 1}\]
Подставим значение \(\gamma\):
\[i = \frac{2}{1,4 - 1} = \frac{2}{0,4} = 5\]
Оба способа дают одинаковый результат.
Ответ:
Молярная масса газа \(M \approx 0,032 \text{ кг/моль}\) (или \(32 \text{ г/моль}\)).
Число степеней свободы молекул газа \(i = 5\).
Задача B24*
Поглощает или выделяет тепло идеальный газ при расширении, если его давление и объем связаны соотношением \(p = \alpha \cdot V\)? Найти подведенное к молю газа (или отведенное от него) количество тепла, если в таком процессе температура газа возросла на величину \(\Delta T\), малую по сравнению с начальной температурой газа. Газ считать двухатомным.
Решение:
Дано:
Процесс: \(p = \alpha \cdot V\)
Газ идеальный, двухатомный.
Изменение температуры: \(\Delta T\) (малое).
Найти: \(Q\) (количество тепла) и определить, поглощается или выделяется.
1. Определим, поглощается или выделяется тепло.
Для идеального газа уравнение состояния Менделеева-Клапейрона для одного моля:
\[pV = RT\]
Подставим заданное соотношение \(p = \alpha \cdot V\):
\[(\alpha \cdot V) \cdot V = RT\]
\[\alpha V^2 = RT\]
Выразим температуру \(T\):
\[T = \frac{\alpha V^2}{R}\]
При расширении объем \(V\) увеличивается. Из формулы видно, что при увеличении \(V\), температура \(T\) также увеличивается (так как \(\alpha\) и \(R\) - положительные постоянные).
\[\frac{dT}{dV} = \frac{2\alpha V}{R} > 0\]
Это означает, что при расширении (\(dV > 0\)) температура газа возрастает (\(dT > 0\)).
Согласно первому началу термодинамики для одного моля газа:
\[\delta Q = dU + \delta A\]
где \(\delta Q\) – подведенное тепло, \(dU\) – изменение внутренней энергии, \(\delta A\) – работа, совершаемая газом.
Изменение внутренней энергии для одного моля идеального газа:
\[dU = C_V dT\]
где \(C_V\) – молярная теплоемкость при постоянном объеме.
Для двухатомного газа число степеней свободы \(i = 5\).
Молярная теплоемкость при постоянном объеме:
\[C_V = \frac{i}{2} R = \frac{5}{2} R\]
Значит, \(dU = \frac{5}{2} R dT\).
Работа, совершаемая газом при расширении:
\[\delta A = p dV\]
Так как газ расширяется, \(dV > 0\). Давление \(p = \alpha V\) всегда положительно. Следовательно, \(\delta A > 0\). Газ совершает положительную работу.
Поскольку температура газа возрастает (\(dT > 0\)), то внутренняя энергия газа увеличивается (\(dU > 0\)).
Так как \(dU > 0\) и \(\delta A > 0\), то \(\delta Q = dU + \delta A > 0\).
Положительное значение \(\delta Q\) означает, что газ поглощает тепло.
2. Найдем количество подведенного тепла \(Q\).
Нам дано, что температура газа возросла на \(\Delta T\), причем \(\Delta T\) мало по сравнению с начальной температурой. Это позволяет использовать дифференциальные соотношения.
\[Q = \Delta U + A\]
Изменение внутренней энергии:
\[\Delta U = C_V \Delta T = \frac{5}{2} R \Delta T\]
Для нахождения работы \(A\) нам нужно проинтегрировать \(p dV\).
\[A = \int p dV\]
Мы знаем, что \(p = \alpha V\).
Также мы знаем, что \(T = \frac{\alpha V^2}{R}\).
Пусть начальная температура \(T_0\) соответствует объему \(V_0\), а конечная температура \(T_0 + \Delta T\) соответствует объему \(V\).
\[T_0 = \frac{\alpha V_0^2}{R}\]
\[T_0 + \Delta T = \frac{\alpha V^2}{R}\]
Вычтем первое уравнение из второго:
\[\Delta T = \frac{\alpha}{R} (V^2 - V_0^2)\]
Так как \(\Delta T\) мало, то \(V\) очень близко к \(V_0\). Пусть \(V = V_0 + dV\).
Тогда \(V^2 - V_0^2 = (V_0 + dV)^2 - V_0^2 = V_0^2 + 2V_0 dV + (dV)^2 - V_0^2 \approx 2V_0 dV\) (пренебрегаем \((dV)^2\) как величиной второго порядка малости).
Значит, \(\Delta T \approx \frac{\alpha}{R} (2V_0 dV)\).
Отсюда \(dV = \frac{R \Delta T}{2\alpha V_0}\).
Работа \(A\) при малом изменении объема:
\[A = p dV\]
где \(p\) можно считать равным начальному давлению \(p_0 = \alpha V_0\).
\[A = (\alpha V_0) \cdot \frac{R \Delta T}{2\alpha V_0} = \frac{R \Delta T}{2}\]
Теперь найдем общее количество тепла \(Q\):
\[Q = \Delta U + A = \frac{5}{2} R \Delta T + \frac{1}{2} R \Delta T\]
\[Q = \left(\frac{5}{2} + \frac{1}{2}\right) R \Delta T = \frac{6}{2} R \Delta T = 3 R \Delta T\]
Проверим еще раз.
Из \(T = \frac{\alpha V^2}{R}\) следует \(dT = \frac{2\alpha V}{R} dV\).
Тогда \(dV = \frac{R dT}{2\alpha V}\).
Работа \(\delta A = p dV = (\alpha V) \frac{R dT}{2\alpha V} = \frac{R}{2} dT\).
Количество тепла \(\delta Q = dU + \delta A = C_V dT + \frac{R}{2} dT = \frac{5}{2} R dT + \frac{R}{2} dT = 3 R dT\).
Интегрируя это выражение для малого изменения температуры \(\Delta T\):
\[Q = \int_{T_0}^{T_0+\Delta T} 3R dT = 3R \Delta T\]
Ответ:
Газ поглощает тепло.
Количество подведенного тепла \(Q = 3 R \Delta T\).