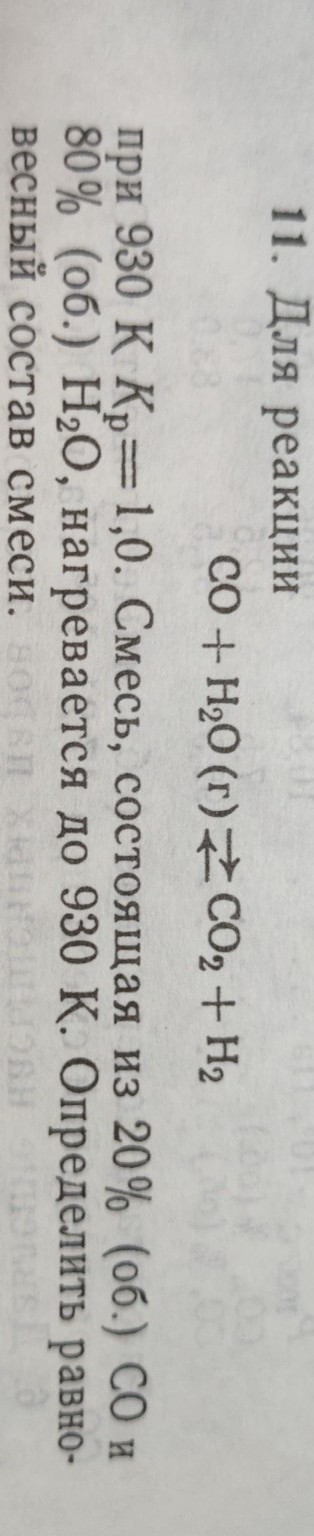Задача 11.
Для реакции
CO + H2O(г) ⇌ CO2 + H2
при 930 К Kp = 1,0. Смесь, состоящая из 20% (об.) CO и 80% (об.) H2O, нагревается до 930 К. Определить равновесный состав смеси.
Решение:
Дана реакция:
CO(г) + H2O(г) ⇌ CO2(г) + H2(г)
Константа равновесия \(K_p = 1,0\).
Начальный состав смеси (объемные проценты, которые для газов эквивалентны мольным процентам):
- CO: 20%
- H2O: 80%
Предположим, что общее начальное количество молей равно 100. Тогда:
- Начальное количество CO: 20 моль
- Начальное количество H2O: 80 моль
- Начальное количество CO2: 0 моль
- Начальное количество H2: 0 моль
Пусть \(x\) моль CO прореагирует. Тогда в равновесии будет:
- CO: \(20 - x\) моль
- H2O: \(80 - x\) моль
- CO2: \(x\) моль
- H2: \(x\) моль
Общее количество молей в равновесии:
\[n_{общ} = (20 - x) + (80 - x) + x + x = 20 - x + 80 - x + x + x = 100 \text{ моль}\]В данном случае общее количество молей не меняется в ходе реакции, так как сумма стехиометрических коэффициентов реагентов равна сумме стехиометрических коэффициентов продуктов (1+1 = 1+1).
Константа равновесия \(K_p\) для данной реакции выражается как:
\[K_p = \frac{P_{CO_2} \cdot P_{H_2}}{P_{CO} \cdot P_{H_2O}}\]Поскольку парциальное давление каждого газа пропорционально его мольной доле (или количеству молей, так как общее количество молей постоянно) и общему давлению \(P\), мы можем записать:
\[K_p = \frac{\left(\frac{n_{CO_2}}{n_{общ}} \cdot P\right) \cdot \left(\frac{n_{H_2}}{n_{общ}} \cdot P\right)}{\left(\frac{n_{CO}}{n_{общ}} \cdot P\right) \cdot \left(\frac{n_{H_2O}}{n_{общ}} \cdot P\right)} = \frac{n_{CO_2} \cdot n_{H_2}}{n_{CO} \cdot n_{H_2O}}\]Подставим равновесные количества молей:
\[1,0 = \frac{x \cdot x}{(20 - x) \cdot (80 - x)}\] \[1,0 = \frac{x^2}{(20 - x)(80 - x)}\]Раскроем знаменатель:
\[(20 - x)(80 - x) = 1600 - 20x - 80x + x^2 = 1600 - 100x + x^2\]Теперь уравнение примет вид:
\[1,0 = \frac{x^2}{1600 - 100x + x^2}\] \[1600 - 100x + x^2 = x^2\] \[1600 - 100x = 0\] \[100x = 1600\] \[x = \frac{1600}{100}\] \[x = 16\]Теперь определим равновесный состав смеси в молях:
- CO: \(20 - x = 20 - 16 = 4\) моль
- H2O: \(80 - x = 80 - 16 = 64\) моль
- CO2: \(x = 16\) моль
- H2: \(x = 16\) моль
Общее количество молей в равновесии, как мы уже выяснили, 100 моль.
Равновесный состав в объемных процентах (или мольных процентах):
- CO: \(\frac{4}{100} \cdot 100\% = 4\%\)
- H2O: \(\frac{64}{100} \cdot 100\% = 64\%\)
- CO2: \(\frac{16}{100} \cdot 100\% = 16\%\)
- H2: \(\frac{16}{100} \cdot 100\% = 16\%\)
Ответ:
Равновесный состав смеси при 930 К:
- CO: 4% (об.)
- H2O: 64% (об.)
- CO2: 16% (об.)
- H2: 16% (об.)