Определение давления пара легколетучей жидкости
Цель работы
Ознакомление с одним из методов определения давления насыщенного пара в зависимости от температуры в равновесной системе жидкость-пар. Расчет молярной теплоты испарения этилового спирта.Общие положения
В соответствии с правилом фаз равновесная однокомпонентная система «жидкость — пар» обладает одной степенью свободы, значит давление насыщенного пара жидкости в такой системе зависит только от температуры. Эта зависимость описывается уравнением Клаузиуса-Клапейрона: \[ \frac{d \ln P}{dT} = \frac{\lambda}{RT^2} \quad (1) \] где \(P\) — упругость пара, атм; \(T\) — абсолютная температура, К; \(\lambda\) — молярная теплота испарения, Дж/моль. Теплота испарения зависит от температуры, однако в небольшом интервале температур можно считать ее величиной постоянной. Тогда из уравнения (1) получим: \[ \ln P = -\frac{\lambda}{RT} + \text{const.} \quad (2) \] Уравнение (2) указывает на линейную связь между логарифмом упругости пара и обратной температурой, поэтому в координатах \(\ln P - \frac{1}{T}\) опытные данные должны укладываться на прямую линию, угловой коэффициент которой равен \(-\frac{\lambda}{R}\). Это дает возможность определить по результатам опыта молярную теплоту испарения. Уравнение (2) можно рассматривать и как зависимость температуры кипения чистой жидкости от внешнего давления, поскольку условием кипения является равенство упругости пара жидкости внешнему давлению.Схема экспериментальной установки

Порядок выполнения работы
1. Закрыв кран 9, откачивают систему до заданного преподавателем давления (0,05-0,1 атм). 2. Включают нагреватель 1 через автотрансформатор 10 в сеть и следят за повышением температуры жидкости. 3. По достижении постоянной температуры записывают показания манометра 6 и термометра 4. 4. С помощью крана 9 увеличивают давление в системе на 0,1 атм и отмечают температуру кипения, отвечающую новому давлению. Опыты проводятся до давления, равного атмосферному.Обработка опытных данных
1. Результаты опытов и необходимых расчетов заносят в таблицу.Таблица
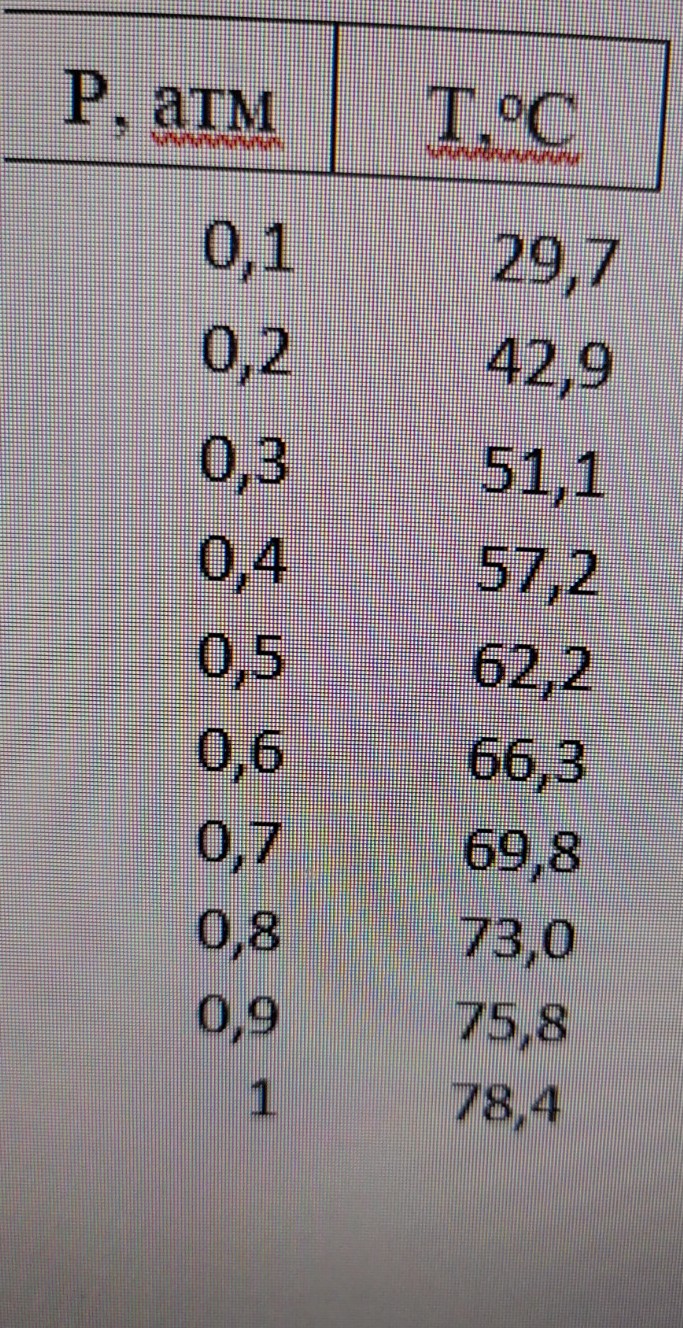
Опытные данные и результаты расчетов
| Номер опыта | \(P\), атм (опыт) | \(\ln P\) | Температура кипения | \(\frac{1}{T}\), К-1 | \(P\), атм (расчет) | |
| \(t\), °C | \(T\), К | |||||
| 1 | 0,1 | -2,30 | 29,7 | 302,85 | 0,003302 | |
| 2 | 0,2 | -1,61 | 42,9 | 316,05 | 0,003164 | |
| 3 | 0,3 | -1,20 | 51,1 | 324,25 | 0,003084 | |
| 4 | 0,4 | -0,92 | 57,2 | 330,35 | 0,003027 | |
| 5 | 0,5 | -0,69 | 62,2 | 335,35 | 0,002982 | |
| 6 | 0,6 | -0,51 | 66,3 | 339,45 | 0,002946 | |
| 7 | 0,7 | -0,36 | 69,8 | 342,95 | 0,002916 | |
| 8 | 0,8 | -0,22 | 73,0 | 346,15 | 0,002889 | |
| 9 | 0,9 | -0,11 | 75,8 | 348,95 | 0,002866 | |
| 10 | 1 | 0,00 | 78,4 | 351,55 | 0,002845 | |
Расчеты для заполнения таблицы:
Для каждого опыта необходимо перевести температуру из градусов Цельсия в Кельвины и рассчитать натуральный логарифм давления, а также обратную температуру.
Формулы для расчетов:
- Температура в Кельвинах: \(T = t + 273,15\)
- Натуральный логарифм давления: \(\ln P\)
- Обратная температура: \(\frac{1}{T}\)
Пример расчета для первого опыта:
- \(P = 0,1\) атм
- \(t = 29,7\) °C
- \(T = 29,7 + 273,15 = 302,85\) К
- \(\ln P = \ln(0,1) \approx -2,30\)
- \(\frac{1}{T} = \frac{1}{302,85} \approx 0,003302\) К-1
Построение графика и определение \(\lambda\):
Для построения графика \(\ln P = f\left(\frac{1}{T}\right)\) используем данные из таблицы. По оси X откладываем значения \(\frac{1}{T}\), а по оси Y — значения \(\ln P\).
График должен представлять собой прямую линию. Уравнение этой прямой: \(\ln P = k \cdot \frac{1}{T} + b\), где \(k\) — угловой коэффициент, \(b\) — постоянная интегрирования.
Из уравнения (2) мы знаем, что \(k = -\frac{\lambda}{R}\).
Универсальная газовая постоянная \(R = 8,314\) Дж/(моль·К).
Для определения углового коэффициента \(k\) можно выбрать две точки на построенной прямой (желательно максимально удаленные друг от друга для большей точности) и использовать формулу:
\[ k = \frac{\ln P_2 - \ln P_1}{\frac{1}{T_2} - \frac{1}{T_1}} \]После нахождения \(k\), можно рассчитать молярную теплоту испарения \(\lambda\):
\[ \lambda = -k \cdot R \]Пример определения \(\lambda\) (используя крайние точки для примера):
Возьмем первую точку (1) и последнюю точку (10) из таблицы:
Точка 1: \(\frac{1}{T_1} = 0,003302\) К-1, \(\ln P_1 = -2,30\)
Точка 10: \(\frac{1}{T_{10}} = 0,002845\) К-1, \(\ln P_{10} = 0,00\)
Рассчитаем угловой коэффициент \(k\):
\[ k = \frac{0,00 - (-2,30)}{0,002845 - 0,003302} = \frac{2,30}{-0,000457} \approx -5032,8 \]Теперь рассчитаем молярную теплоту испарения \(\lambda\):
\[ \lambda = -k \cdot R = -(-5032,8) \cdot 8,314 \approx 41840,6 \text{ Дж/моль} \]или \(\lambda \approx 41,84\) кДж/моль.
Определение постоянной интегрирования \(const.\) (или \(b\)):
Используя уравнение прямой \(\ln P = k \cdot \frac{1}{T} + b\) и одну из точек, например, точку 10:
\[ 0,00 = -5032,8 \cdot 0,002845 + b \] \[ 0,00 = -14,31 + b \] \[ b \approx 14,31 \]Таким образом, постоянная интегрирования \(const. \approx 14,31\).
Вывод
В ходе выполнения работы был изучен метод определения давления насыщенного пара легколетучей жидкости в зависимости от температуры. Была построена зависимость \(\ln P = f\left(\frac{1}{T}\right)\), которая подтвердила линейный характер, соответствующий уравнению Клаузиуса-Клапейрона. По углу наклона полученной прямой была рассчитана молярная теплота испарения этилового спирта, которая составила примерно 41,84 кДж/моль. Также была определена постоянная интегрирования, равная приблизительно 14,31. Полученные результаты позволяют характеризовать процесс испарения исследуемой жидкости.