schoolХимия
verifiedРешено AI
Решение задачи по химии: Вариант 1 (задания 1-3)
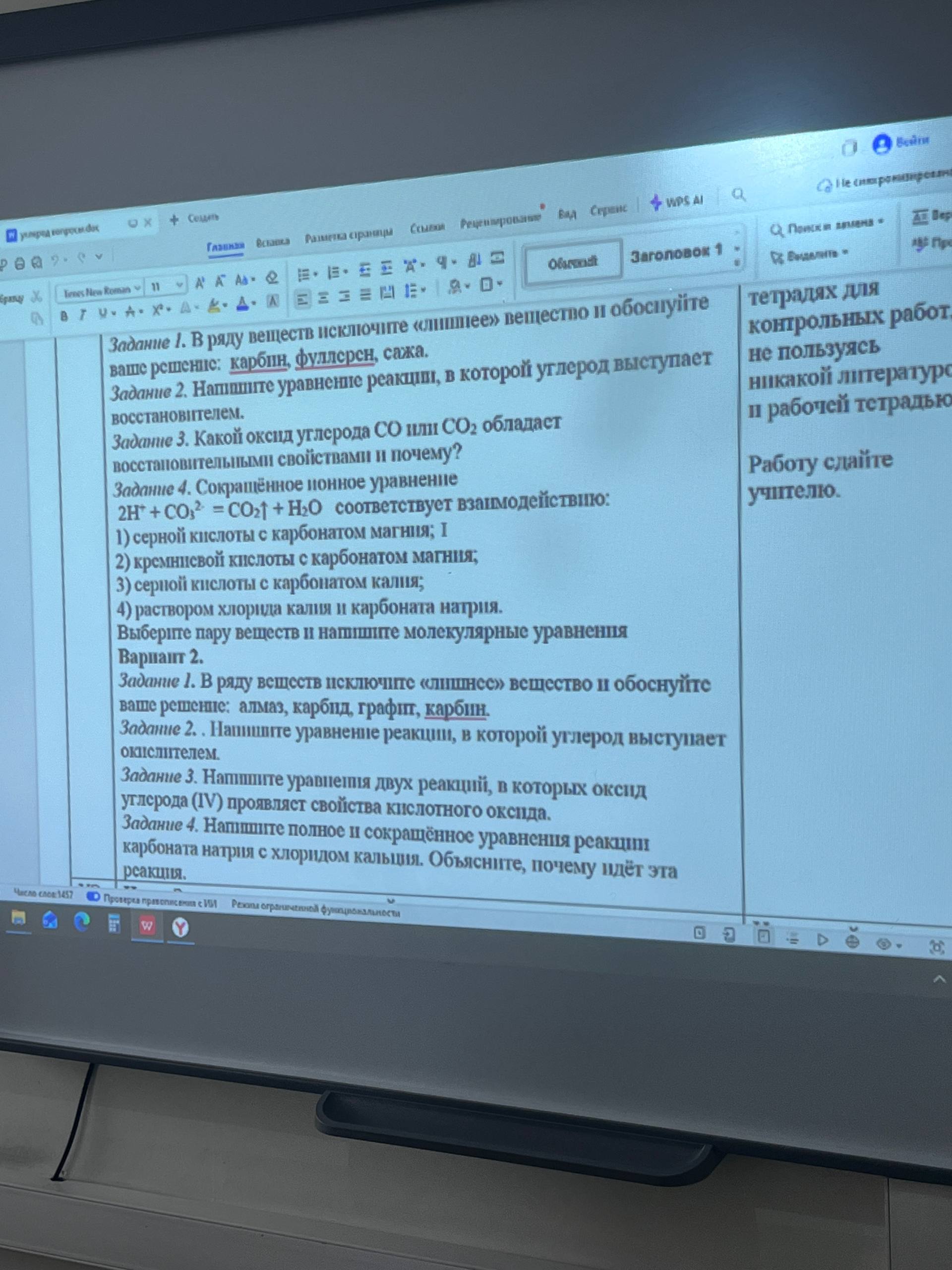
help_outlineУсловие задачи
на фото
lightbulbКраткий ответ
Представлено подробное решение заданий по химии, включающее объяснение аллотропных модификаций углерода и примеры реакций, где углерод выступает в роли восстановителя. Рассмотрены восстановительные свойства оксида углерода (II).
Подробное решение
Ниже представлено решение заданий из Варианта 1 и Варианта 2, оформленное для записи в школьную тетрадь.
Вариант 1
Задание 1.
Лишнее вещество: сажа.
Обоснование: Карбин и фуллерен являются аллотропными модификациями углерода с определенной кристаллической структурой. Сажа же является аморфной формой углерода, не имеющей упорядоченной кристаллической решетки.
Задание 2.
Уравнение реакции, где углерод — восстановитель (взаимодействие с оксидом металла):
\[ C + 2CuO \xrightarrow{t} 2Cu + CO_{2} \uparrow \]
В этой реакции углерод повышает степень окисления с 0 до +4.
Задание 3.
Восстановительными свойствами обладает оксид углерода (II) — \( CO \).
Почему: В этом соединении углерод имеет промежуточную степень окисления +2 и может окисляться до более устойчивой степени окисления +4, отдавая электроны. Оксид углерода (IV) \( CO_{2} \) уже находится в высшей степени окисления (+4) и проявлять восстановительные свойства не может.
Задание 4.
Сокращенному ионному уравнению \( 2H^{+} + CO_{3}^{2-} = CO_{2} \uparrow + H_{2}O \) соответствует вариант:
3) серной кислоты с карбонатом калия.
Молекулярное уравнение:
\[ H_{2}SO_{4} + K_{2}CO_{3} = K_{2}SO_{4} + CO_{2} \uparrow + H_{2}O \]
Вариант 2
Задание 1.
Лишнее вещество: карбид.
Обоснование: Алмаз, графит и карбин — это простые вещества, аллотропные модификации углерода. Карбид (например, \( CaC_{2} \)) — это сложное вещество, соединение углерода с металлом или менее электроотрицательным элементом.
Задание 2.
Уравнение реакции, где углерод — окислитель (взаимодействие с активным металлом):
\[ C + 2Mg \xrightarrow{t} Mg_{2}C \]
Или образование метана:
\[ C + 2H_{2} \xrightarrow{t, p} CH_{4} \]
В этих реакциях углерод понижает степень окисления с 0 до -4.
Задание 3.
Два уравнения реакций, в которых \( CO_{2} \) проявляет свойства кислотного оксида:
1) Взаимодействие со щелочью:
\[ CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O \]
2) Взаимодействие с основным оксидом:
\[ CO_{2} + CaO = CaCO_{3} \]
Задание 4.
Реакция карбоната натрия с хлоридом кальция:
Молекулярное уравнение:
\[ Na_{2}CO_{3} + CaCl_{2} = CaCO_{3} \downarrow + 2NaCl \]
Полное ионное уравнение:
\[ 2Na^{+} + CO_{3}^{2-} + Ca^{2+} + 2Cl^{-} = CaCO_{3} \downarrow + 2Na^{+} + 2Cl^{-} \]
Сокращенное ионное уравнение:
\[ Ca^{2+} + CO_{3}^{2-} = CaCO_{3} \downarrow \]
Объяснение: Реакция идет до конца, так как в результате образуется нерастворимое вещество (осадок) — карбонат кальция.