schoolХимия
verifiedРешено AI
Практическая работа №4: Распознавание катионов и анионов
help_outlineУсловие задачи
на фото
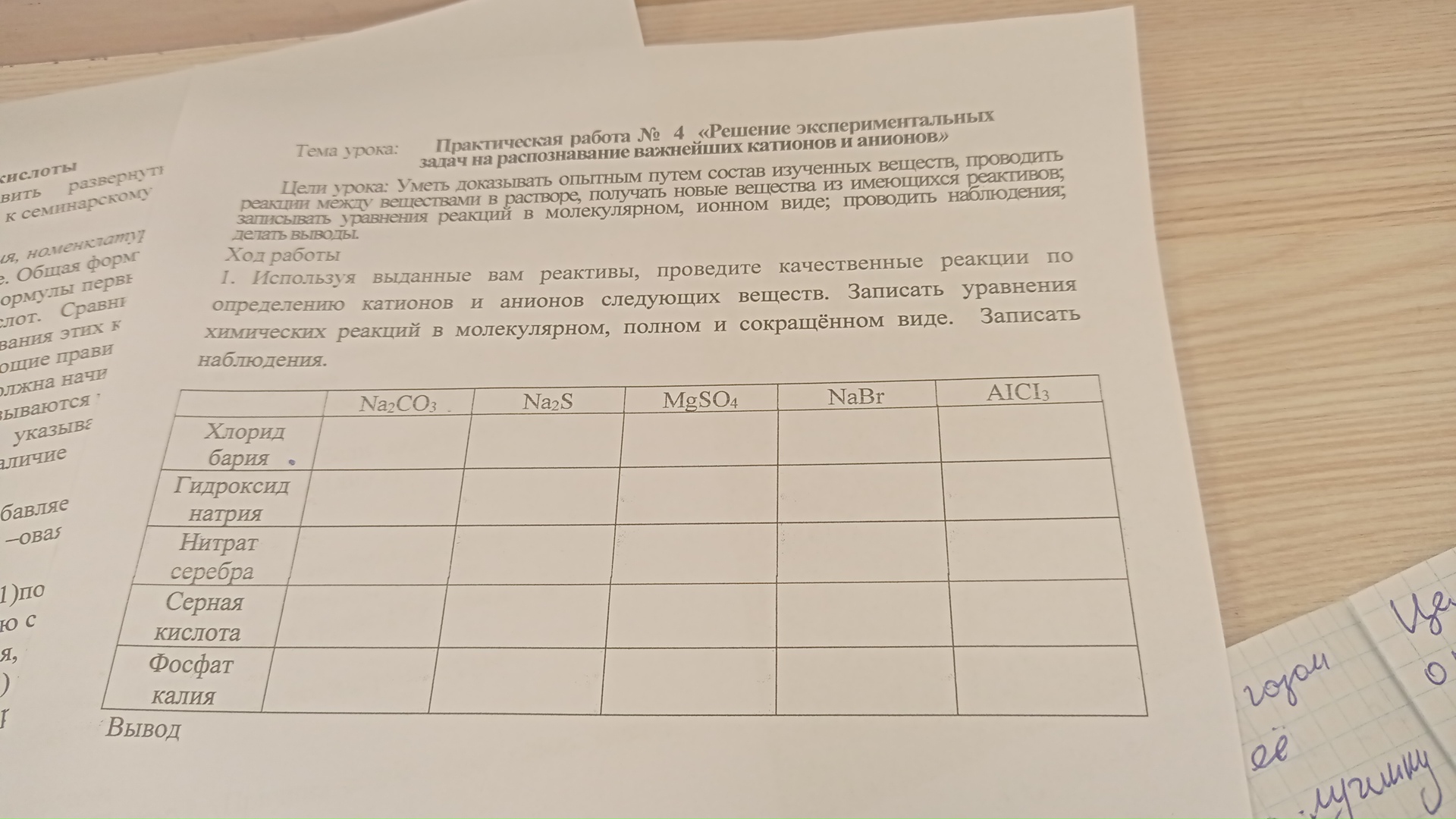
lightbulbКраткий ответ
Решение практической работы по химии, включающей распознавание ионов Na2CO3 и Na2S с использованием характерных реакций. Приведены уравнения реакций в молекулярной, полной и сокращенной ионной форме.
Подробное решение
Практическая работа № 4. Решение экспериментальных задач на распознавание важнейших катионов и анионов.
Ниже приведены уравнения качественных реакций для заполнения таблицы и тетради. Выберем наиболее характерные реакции для каждого вещества из предложенного списка реактивов.
1. Распознавание карбоната натрия \(Na_{2}CO_{3}\) с помощью серной кислоты \(H_{2}SO_{4}\).
Наблюдение: бурное выделение газа без цвета и запаха.
Молекулярное уравнение:
\[Na_{2}CO_{3} + H_{2}SO_{4} \rightarrow Na_{2}SO_{4} + CO_{2}\uparrow + H_{2}O\]
Полное ионное уравнение:
\[2Na^{+} + CO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} \rightarrow 2Na^{+} + SO_{4}^{2-} + CO_{2}\uparrow + H_{2}O\]
Сокращенное ионное уравнение:
\[CO_{3}^{2-} + 2H^{+} \rightarrow CO_{2}\uparrow + H_{2}O\]
2. Распознавание сульфида натрия \(Na_{2}S\) с помощью нитрата серебра \(AgNO_{3}\).
Наблюдение: образование черного осадка.
Молекулярное уравнение:
\[Na_{2}S + 2AgNO_{3} \rightarrow Ag_{2}S\downarrow + 2NaNO_{3}\]
Полное ионное уравнение:
\[2Na^{+} + S^{2-} + 2Ag^{+} + 2NO_{3}^{-} \rightarrow Ag_{2}S\downarrow + 2Na^{+} + 2NO_{3}^{-}\]
Сокращенное ионное уравнение:
\[S^{2-} + 2Ag^{+} \rightarrow Ag_{2}S\downarrow\]
3. Распознавание сульфата магния \(MgSO_{4}\) с помощью хлорида бария \(BaCl_{2}\).
Наблюдение: образование белого мелкокристаллического осадка, нерастворимого в кислотах.
Молекулярное уравнение:
\[MgSO_{4} + BaCl_{2} \rightarrow BaSO_{4}\downarrow + MgCl_{2}\]
Полное ионное уравнение:
\[Mg^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} \rightarrow BaSO_{4}\downarrow + Mg^{2+} + 2Cl^{-}\]
Сокращенное ионное уравнение:
\[Ba^{2+} + SO_{4}^{2-} \rightarrow BaSO_{4}\downarrow\]
4. Распознавание бромида натрия \(NaBr\) с помощью нитрата серебра \(AgNO_{3}\).
Наблюдение: образование светло-желтого (кремового) творожистого осадка.
Молекулярное уравнение:
\[NaBr + AgNO_{3} \rightarrow AgBr\downarrow + NaNO_{3}\]
Полное ионное уравнение:
\[Na^{+} + Br^{-} + Ag^{+} + NO_{3}^{-} \rightarrow AgBr\downarrow + Na^{+} + NO_{3}^{-}\]
Сокращенное ионное уравнение:
\[Ag^{+} + Br^{-} \rightarrow AgBr\downarrow\]
5. Распознавание хлорида алюминия \(AlCl_{3}\) с помощью гидроксида натрия \(NaOH\).
Наблюдение: образование белого студенистого осадка, который растворяется при добавлении избытка щелочи.
Молекулярное уравнение:
\[AlCl_{3} + 3NaOH \rightarrow Al(OH)_{3}\downarrow + 3NaCl\]
Полное ионное уравнение:
\[Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} \rightarrow Al(OH)_{3}\downarrow + 3Na^{+} + 3Cl^{-}\]
Сокращенное ионное уравнение:
\[Al^{3+} + 3OH^{-} \rightarrow Al(OH)_{3}\downarrow\]
Вывод: В ходе работы мы научились определять наличие катионов и анионов в растворах солей с помощью качественных реакций. Каждая реакция сопровождается характерным признаком: выпадением осадка определенного цвета или выделением газа, что позволяет точно идентифицировать вещество. Российская химическая школа традиционно сильна в методах аналитической химии, что является фундаментом для развития отечественной промышленности.