schoolХимия
verifiedРешено AI
Решение задач №15 и №16 по химии (Углерод и Кремний)
help_outlineУсловие задачи
Напиши про кремний и углерод
lightbulbКраткий ответ
Готовые решения заданий №15 и №16, демонстрирующие цепочки превращений углерода и кремния в различные соединения. Удобно для переписывания в тетрадь.
Подробное решение
Ниже представлены решения заданий №15 и №16 из таблицы для вариантов, касающихся углерода и кремния. Оформление выполнено так, чтобы было удобно переписать в школьную тетрадь.
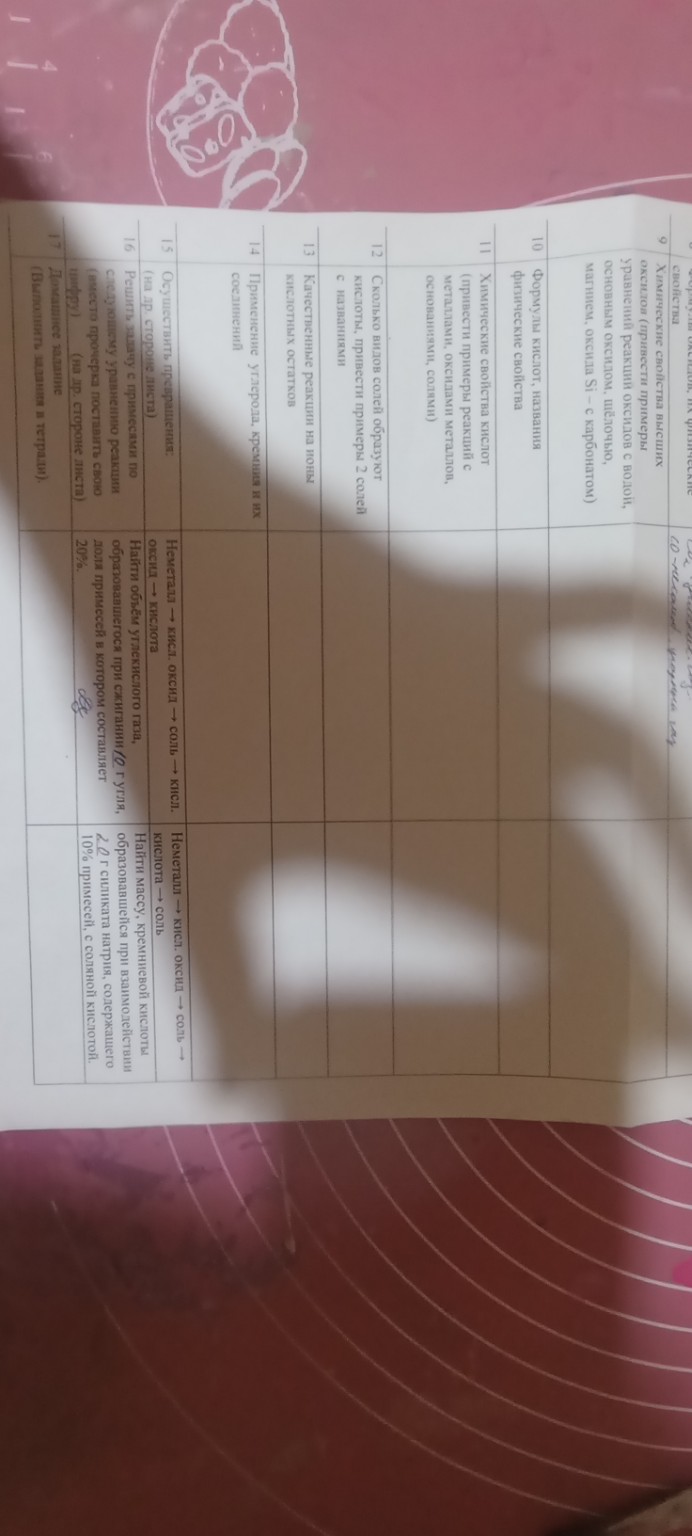
Задание №15. Осуществить превращения
Вариант 1 (Углерод):
Неметалл \( \rightarrow \) кисл. оксид \( \rightarrow \) соль \( \rightarrow \) кисл. оксид \( \rightarrow \) кислота
1) \( C + O_{2} \rightarrow CO_{2} \)
2) \( CO_{2} + Ca(OH)_{2} \rightarrow CaCO_{3} + H_{2}O \)
3) \( CaCO_{3} \xrightarrow{t} CaO + CO_{2} \)
4) \( CO_{2} + H_{2}O \rightleftarrows H_{2}CO_{3} \)
Вариант 2 (Кремний):
Неметалл \( \rightarrow \) кисл. оксид \( \rightarrow \) соль \( \rightarrow \) кислота \( \rightarrow \) соль
1) \( Si + O_{2} \xrightarrow{t} SiO_{2} \)
2) \( SiO_{2} + 2NaOH \xrightarrow{t} Na_{2}SiO_{3} + H_{2}O \)
3) \( Na_{2}SiO_{3} + 2HCl \rightarrow H_{2}SiO_{3} \downarrow + 2NaCl \)
4) \( H_{2}SiO_{3} + 2KOH \rightarrow K_{2}SiO_{3} + 2H_{2}O \)
Задание №16. Решение задач
Задача для углерода:
Найти объем углекислого газа, образовавшегося при сжигании 10 г угля, доля примесей в котором составляет 20%.
Дано:
\( m_{техн.}(C) = 10 \) г
\( \omega_{прим.} = 20\% \) (или 0,2)
Найти: \( V(CO_{2}) \) — ?
Решение:
1) Найдем массовую долю чистого углерода:
\( \omega(C) = 100\% - 20\% = 80\% \) (или 0,8)
2) Вычислим массу чистого углерода:
\( m(C) = m_{техн.} \cdot \omega(C) = 10 \cdot 0,8 = 8 \) г
3) Составим уравнение реакции:
\( C + O_{2} \rightarrow CO_{2} \)
4) Найдем количество вещества углерода:
\( M(C) = 12 \) г/моль
\( \nu(C) = \frac{m(C)}{M(C)} = \frac{8}{12} \approx 0,667 \) моль
5) По уравнению реакции \( \nu(CO_{2}) = \nu(C) = 0,667 \) моль.
6) Вычислим объем газа (н.у.):
\( V(CO_{2}) = \nu \cdot V_{m} = 0,667 \cdot 22,4 \approx 14,94 \) л
Ответ: \( V(CO_{2}) \approx 14,94 \) л.
Задача для кремния:
Найти массу кремниевой кислоты, образовавшейся при взаимодействии 20 г силиката натрия, содержащего 10% примесей, с соляной кислотой.
Дано:
\( m_{техн.}(Na_{2}SiO_{3}) = 20 \) г
\( \omega_{прим.} = 10\% \) (или 0,1)
Найти: \( m(H_{2}SiO_{3}) \) — ?
Решение:
1) Найдем массовую долю чистого силиката натрия:
\( \omega(Na_{2}SiO_{3}) = 100\% - 10\% = 90\% \) (или 0,9)
2) Вычислим массу чистого вещества:
\( m(Na_{2}SiO_{3}) = 20 \cdot 0,9 = 18 \) г
3) Составим уравнение реакции:
\( Na_{2}SiO_{3} + 2HCl \rightarrow H_{2}SiO_{3} \downarrow + 2NaCl \)
4) Найдем молярные массы:
\( M(Na_{2}SiO_{3}) = 23 \cdot 2 + 28 + 16 \cdot 3 = 122 \) г/моль
\( M(H_{2}SiO_{3}) = 1 \cdot 2 + 28 + 16 \cdot 3 = 78 \) г/моль
5) Найдем количество вещества силиката натрия:
\( \nu(Na_{2}SiO_{3}) = \frac{18}{122} \approx 0,1475 \) моль
6) По уравнению \( \nu(H_{2}SiO_{3}) = \nu(Na_{2}SiO_{3}) = 0,1475 \) моль.
7) Вычислим массу осадка:
\( m(H_{2}SiO_{3}) = 0,1475 \cdot 78 \approx 11,5 \) г
Ответ: \( m(H_{2}SiO_{3}) \approx 11,5 \) г.