schoolМатематика
verifiedРешено AI
Решение задачи: Обжиг пирита и расчет объема сернистого газа
help_outlineУсловие задачи
Найти правильный ответ Реши задачу: Найти правильный Реши задачу: Найти правильный ответ Реши задачу: Найти правильный ответ
lightbulbКраткий ответ
При обжиге 24 г пирита образуется 8,96 л сернистого газа (SO2) при нормальных условиях. Решение включает расчет молярной массы пирита и применение уравнения реакции.
Подробное решение
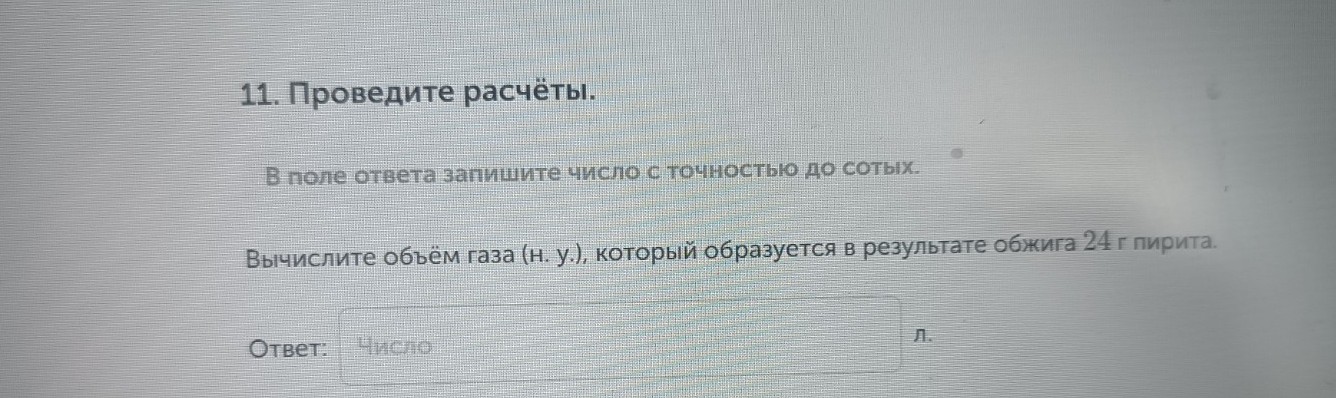
Задание 11. Вычислите объём газа (н. у.), который образуется в результате обжига \(24\) г пирита.
Ответ: \(8,96\) л.
Запись в тетрадь:
Дано:
\(m(FeS_{2}) = 24\) г
\(V_{m} = 22,4\) л/моль
Найти:
\(V(SO_{2}) - ?\)
Решение:
1. Составим уравнение реакции обжига пирита:
\[4FeS_{2} + 11O_{2} \xrightarrow{t} 2Fe_{2}O_{3} + 8SO_{2}\]
Газом, образующимся в данной реакции, является сернистый газ — \(SO_{2}\).
2. Рассчитаем молярную массу пирита (\(FeS_{2}\)):
\[M(FeS_{2}) = 56 + 32 \cdot 2 = 120 \text{ г/моль}\]
3. Найдем количество вещества пирита:
\[n(FeS_{2}) = \frac{m}{M} = \frac{24 \text{ г}}{120 \text{ г/моль}} = 0,2 \text{ моль}\]
4. По уравнению реакции определим количество вещества \(SO_{2}\). Из \(4\) моль \(FeS_{2}\) образуется \(8\) моль \(SO_{2}\) (соотношение \(1:2\)):
\[n(SO_{2}) = 2 \cdot n(FeS_{2}) = 2 \cdot 0,2 = 0,4 \text{ моль}\]
5. Вычислим объём газа при нормальных условиях:
\[V(SO_{2}) = n \cdot V_{m} = 0,4 \text{ моль} \cdot 22,4 \text{ л/моль} = 8,96 \text{ л}\]