schoolМатематика
verifiedРешено AI
Решение ОВР: Cu + H2SO4 (конц.) → CuSO4 + SO2 + H2O
help_outlineУсловие задачи
Овр
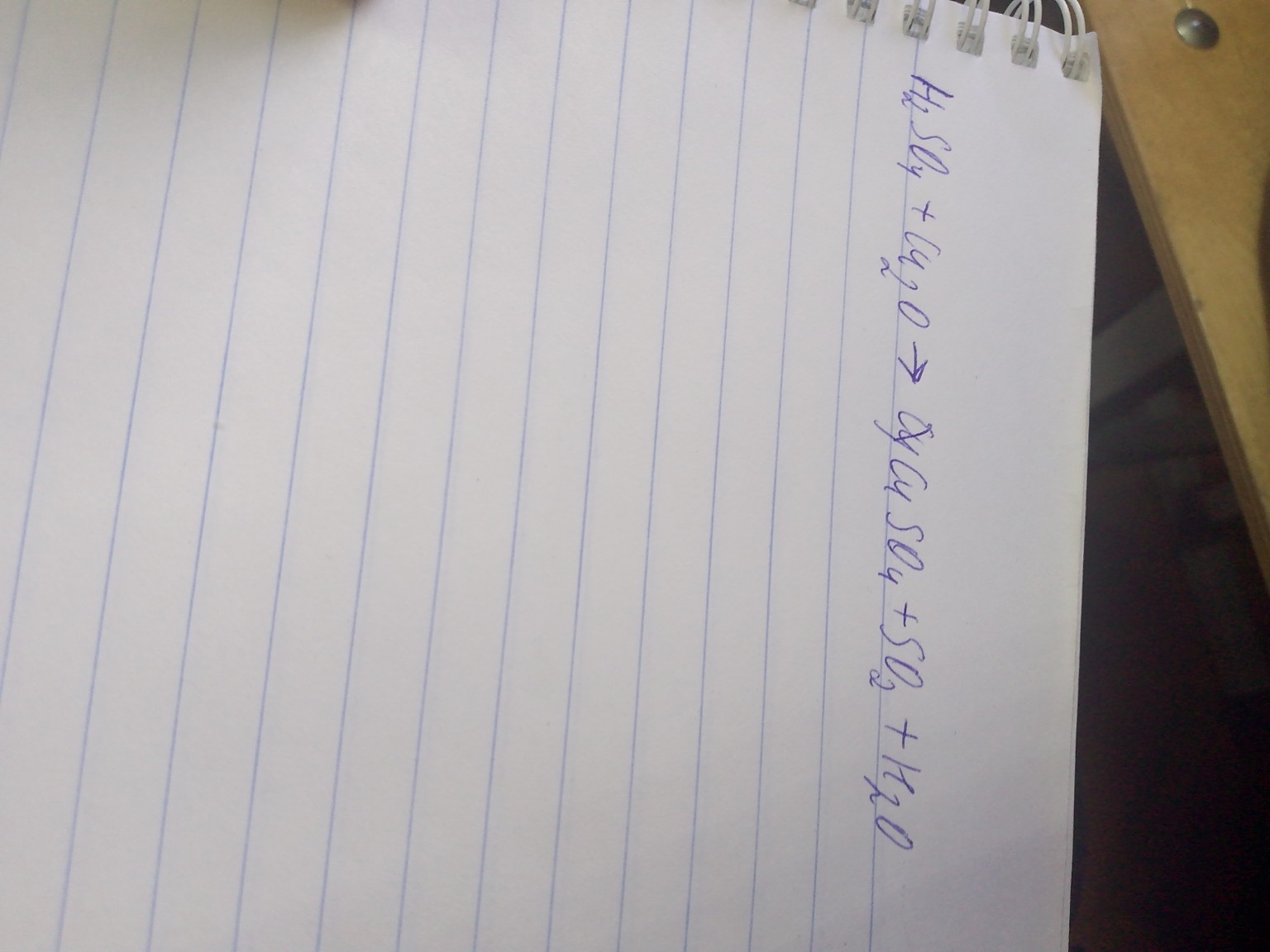
lightbulbКраткий ответ
В реакции меди с концентрированной серной кислотой медь является восстановителем, а сера в серной кислоте - окислителем. В результате образуются сульфат меди, сернистый газ и вода.
Подробное решение
Для решения данной окислительно-восстановительной реакции (ОВР) необходимо составить электронный баланс, определить окислитель и восстановитель, а затем расставить коэффициенты.
Запишем уравнение реакции:
\[ Cu + H_{2}SO_{4(конц.)} \rightarrow CuSO_{4} + SO_{2} \uparrow + H_{2}O \]
1. Определим степени окисления элементов, которые их меняют:
Медь в свободном состоянии имеет степень окисления 0, в составе сульфата меди — +2.
Сера в серной кислоте имеет степень окисления +6, в составе сернистого газа — +4.
\[ Cu^{0} + H_{2}S^{+6}O_{4} \rightarrow Cu^{+2}SO_{4} + S^{+4}O_{2} + H_{2}O \]
2. Составим схему электронного баланса:
\[ \begin{array}{l|l} Cu^{0} - 2\bar{e} \rightarrow Cu^{+2} & 1 \\ S^{+6} + 2\bar{e} \rightarrow S^{+4} & 1 \end{array} \]
3. Определим роли веществ:
\( Cu^{0} \) — восстановитель (процесс окисления).
\( S^{+6} \) (в \( H_{2}SO_{4} \)) — окислитель (процесс восстановления).
4. Расставим коэффициенты в уравнении:
Перед \( CuSO_{4} \) и \( SO_{2} \) коэффициенты 1 (не пишутся).
Считаем общее количество атомов серы справа: 1 (в сульфате) + 1 (в газе) = 2. Значит, перед \( H_{2}SO_{4} \) ставим коэффициент 2.
Теперь уравниваем водород: слева 4 атома (\( 2 \times 2 \)), значит перед \( H_{2}O \) ставим коэффициент 2.
Итоговое уравнение:
\[ Cu + 2H_{2}SO_{4(конц.)} \rightarrow CuSO_{4} + SO_{2} \uparrow + 2H_{2}O \]