schoolХимия
verifiedРешено AI
Расчет координат для графика кондуктометрического титрования
help_outlineУсловие задачи
Расчитай координаты для графика, к 5 заданию Реши задачу: Расчитай координаты для графика
lightbulbКраткий ответ
Решение задачи кондуктометрического титрования включает расчет координат для построения графика зависимости электропроводности от объема добавленного титранта, что позволяет определить точку эквивалентности.
Подробное решение
Для решения задачи кондуктометрического титрования необходимо построить график зависимости удельной электропроводности \(\chi\) от объема добавленного титранта \(V(HCl)\). Точка эквивалентности находится как точка пересечения двух прямых, описывающих изменение электропроводности до и после завершения реакции.
Ниже приведены координаты и алгоритм решения для записи в тетрадь.
Дано:
\(V(NH_4OH) = 20,00 \text{ см}^3\)
\(C_{экв}(HCl) = 0,4950 \text{ моль/дм}^3\)
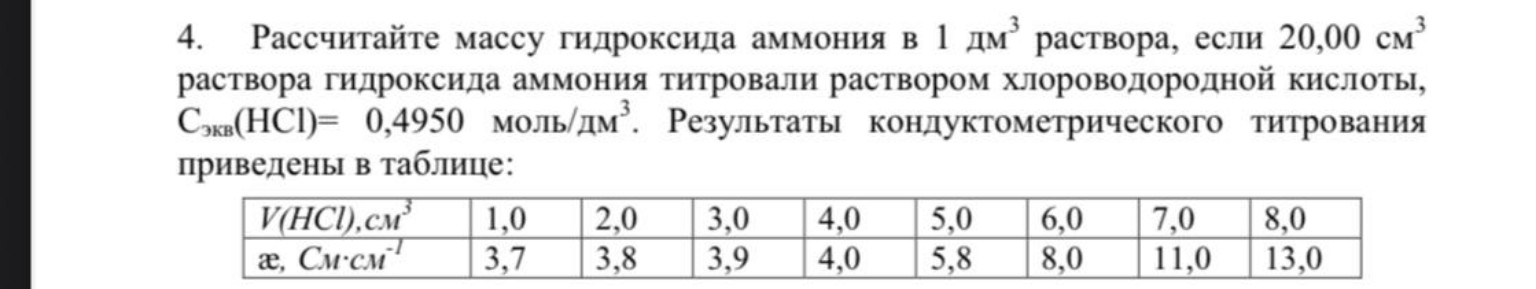
Таблица данных титрования:
1. \(V = 1,0 \text{ см}^3, \chi = 3,7\)
2. \(V = 2,0 \text{ см}^3, \chi = 3,8\)
3. \(V = 3,0 \text{ см}^3, \chi = 3,9\)
4. \(V = 4,0 \text{ см}^3, \chi = 4,0\)
5. \(V = 5,0 \text{ см}^3, \chi = 5,8\)
6. \(V = 6,0 \text{ см}^3, \chi = 8,0\)
7. \(V = 7,0 \text{ см}^3, \chi = 11,0\)
8. \(V = 8,0 \text{ см}^3, \chi = 13,0\)
Решение:
1. Координаты для построения графика (ось X — \(V(HCl)\), ось Y — \(\chi\)):
Первая ветвь (до точки эквивалентности):
(1,0; 3,7), (2,0; 3,8), (3,0; 3,9), (4,0; 4,0)
Вторая ветвь (после точки эквивалентности):
(5,0; 5,8), (6,0; 8,0), (7,0; 11,0), (8,0; 13,0)
2. Определение точки эквивалентности \(V_{экв}\):
Необходимо провести две прямые через указанные группы точек. Точка их пересечения даст объем титранта в точке эквивалентности.
Математически (методом приравнивания уравнений прямых):
Уравнение 1: \(\chi = 0,1V + 3,6\)
Уравнение 2: \(\chi = 2,4V - 6,0\) (приблизительно по точкам 6.0-8.0)
При пересечении: \(0,1V + 3,6 = 2,4V - 6,0 \Rightarrow 2,3V = 9,6 \Rightarrow V_{экв} \approx 4,17 \text{ см}^3\).
Для школьной тетради обычно достаточно графического нахождения: \(V_{экв} \approx 4,2 \text{ см}^3\).
3. Расчет массы гидроксида аммония \(NH_4OH\):
Молярная масса эквивалента \(M_{экв}(NH_4OH) = 35,05 \text{ г/моль}\).
Сначала найдем массу в титруемом объеме (\(20 \text{ см}^3\)):
\[ m = \frac{C_{экв}(HCl) \cdot V_{экв}(HCl) \cdot M_{экв}(NH_4OH)}{1000} \]
\[ m = \frac{0,4950 \cdot 4,2 \cdot 35,05}{1000} \approx 0,07287 \text{ г} \]
Рассчитаем массу в \(1 \text{ дм}^3\) (\(1000 \text{ см}^3\)) раствора:
\[ m(в 1 дм^3) = \frac{m \cdot 1000}{V(NH_4OH)} \]
\[ m(в 1 дм^3) = \frac{0,07287 \cdot 1000}{20} = 3,6435 \text{ г} \]
Ответ: Масса гидроксида аммония в \(1 \text{ дм}^3\) раствора составляет \(3,64 \text{ г}\).