schoolФизика
verifiedРешено AI
Решение задачи по термодинамике (Вариант 14)
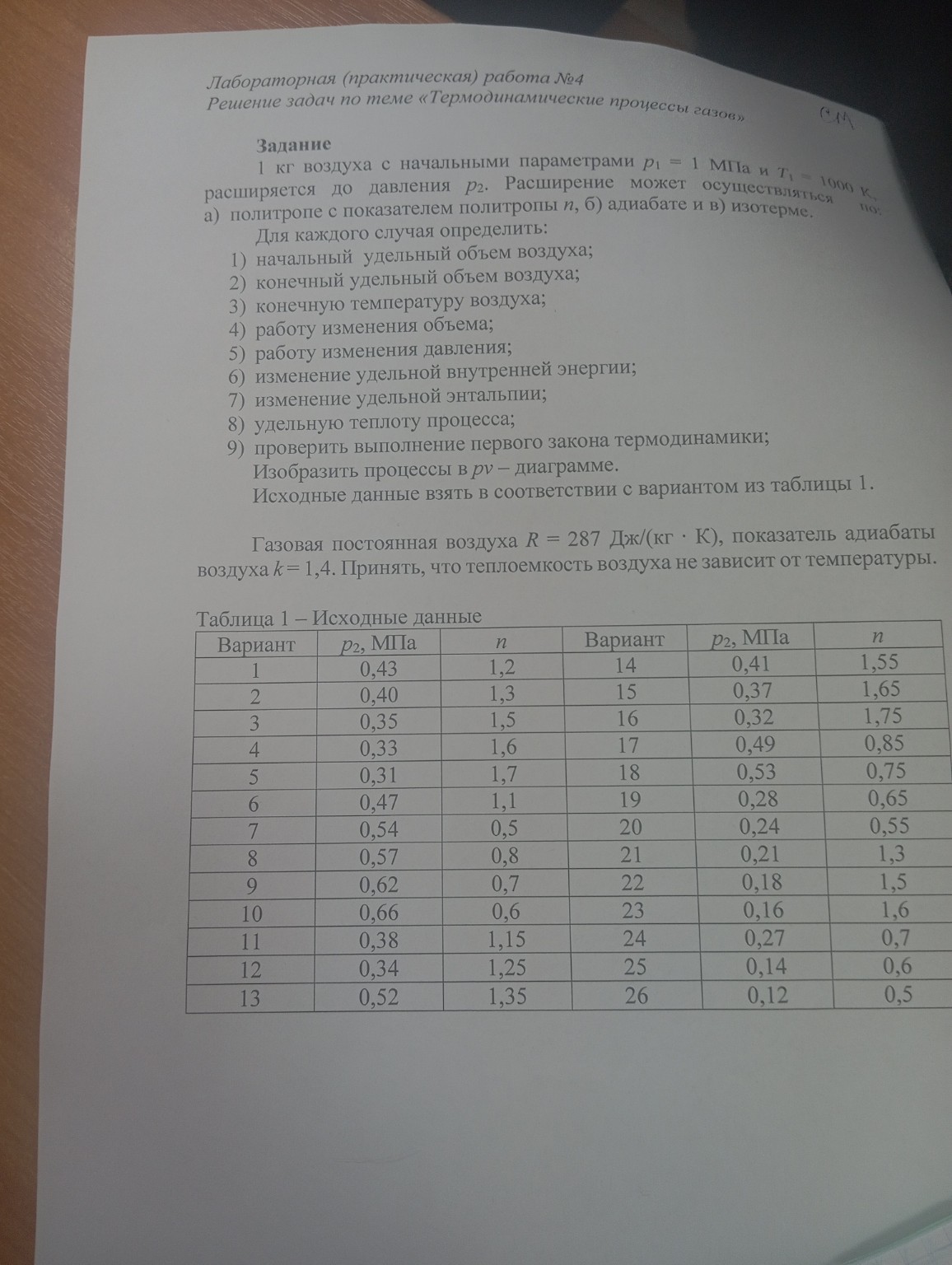
help_outlineУсловие задачи
Реши 14 вариант по программе СПО
lightbulbКраткий ответ
Представлено решение задачи по термодинамике газов, включающее расчеты для политропного, адиабатного и изотермического процессов. Найдены конечные удельные объемы для каждого процесса.
Подробное решение
Лабораторная работа №4
Решение задач по теме «Термодинамические процессы газов»
Вариант 14
Дано:
\(m = 1\) кг
\(p_1 = 1\) МПа = \(10^6\) Па
\(T_1 = 1000\) К
\(p_2 = 0,41\) МПа = \(0,41 \cdot 10^6\) Па
\(n = 1,55\) (для политропного процесса)
\(R = 287\) Дж/(кг \(\cdot\) К)
\(k = 1,4\)
Решение:
1) Начальный удельный объем воздуха \(v_1\):
Из уравнения состояния идеального газа \(p_1 v_1 = R T_1\):
\[v_1 = \frac{R T_1}{p_1} = \frac{287 \cdot 1000}{10^6} = 0,287 \text{ м}^3/\text{кг}\]
Рассмотрим три процесса расширения:
а) Политропный (\(n = 1,55\))
б) Адиабатный (\(k = 1,4\))
в) Изотермический (\(T = \text{const}\), \(n = 1\))
а) Политропный процесс (\(n = 1,55\))
2) Конечный удельный объем \(v_{2п}\):
Из уравнения политропы \(p_1 v_1^n = p_2 v_{2п}^n\):
\[v_{2п} = v_1 \cdot \left( \frac{p_1}{p_2} \right)^{1/n} = 0,287 \cdot \left( \frac{1}{0,41} \right)^{1/1,55} \approx 0,287 \cdot 1,781 = 0,511 \text{ м}^3/\text{кг}\]
3) Конечная температура \(T_{2п}\):
\[T_{2п} = T_1 \cdot \left( \frac{p_2}{p_1} \right)^{\frac{n-1}{n}} = 1000 \cdot \left( \frac{0,41}{1} \right)^{\frac{1,55-1}{1,55}} = 1000 \cdot 0,41^{0,355} \approx 728,5 \text{ К}\]
4) Работа изменения объема \(l_п\):
\[l_п = \frac{R(T_1 - T_{2п})}{n - 1} = \frac{287 \cdot (1000 - 728,5)}{1,55 - 1} = \frac{287 \cdot 271,5}{0,55} \approx 141674 \text{ Дж/кг}\]
5) Работа изменения давления (располагаемая работа) \(l_{0п}\):
\[l_{0п} = n \cdot l_п = 1,55 \cdot 141674 \approx 219595 \text{ Дж/кг}\]
6) Изменение удельной внутренней энергии \(\Delta u_п\):
\[c_v = \frac{R}{k - 1} = \frac{287}{1,4 - 1} = 717,5 \text{ Дж/(кг} \cdot \text{К)}\]
\[\Delta u_п = c_v (T_{2п} - T_1) = 717,5 \cdot (728,5 - 1000) \approx -194801 \text{ Дж/кг}\]
7) Изменение удельной энтальпии \(\Delta h_п\):
\[c_p = k \cdot c_v = 1,4 \cdot 717,5 = 1004,5 \text{ Дж/(кг} \cdot \text{К)}\]
\[\Delta h_п = c_p (T_{2п} - T_1) = 1004,5 \cdot (728,5 - 1000) \approx -272722 \text{ Дж/кг}\]
8) Удельная теплота процесса \(q_п\):
Удельная теплоемкость политропного процесса:
\[c_п = c_v \frac{n - k}{n - 1} = 717,5 \cdot \frac{1,55 - 1,4}{1,55 - 1} = 717,5 \cdot \frac{0,15}{0,55} \approx 195,7 \text{ Дж/(кг} \cdot \text{К)}\]
\[q_п = c_п (T_{2п} - T_1) = 195,7 \cdot (728,5 - 1000) \approx -53132 \text{ Дж/кг}\]
9) Проверка первого закона термодинамики:
\[q_п = \Delta u_п + l_п\]
\[-53132 \approx -194801 + 141674 = -53127\]
(Разница в 5 единиц обусловлена округлениями, закон выполняется).
б) Адиабатный процесс (\(k = 1,4\))
2) \(v_{2а} = v_1 \cdot (p_1/p_2)^{1/k} = 0,287 \cdot (1/0,41)^{1/1,4} \approx 0,542 \text{ м}^3/\text{кг}\)
3) \(T_{2а} = T_1 \cdot (p_2/p_1)^{(k-1)/k} = 1000 \cdot (0,41)^{0,286} \approx 774,5 \text{ К}\)
4) \(l_а = \frac{R(T_1 - T_{2а})}{k - 1} = \frac{287 \cdot (1000 - 774,5)}{0,4} = 161794 \text{ Дж/кг}\)
5) \(l_{0а} = k \cdot l_а = 1,4 \cdot 161794 = 226512 \text{ Дж/кг}\)
6) \(\Delta u_а = c_v (T_{2а} - T_1) = 717,5 \cdot (774,5 - 1000) = -161796 \text{ Дж/кг}\)
7) \(\Delta h_а = c_p (T_{2а} - T_1) = 1004,5 \cdot (774,5 - 1000) = -226515 \text{ Дж/кг}\)
8) \(q_а = 0\) (по определению адиабаты)
9) Проверка: \(0 = -161796 + 161794 \approx 0\) (выполняется).
в) Изотермический процесс (\(T = \text{const} = 1000\) К)
2) \(v_{2из} = v_1 \cdot (p_1/p_2) = 0,287 \cdot (1/0,41) \approx 0,7 \text{ м}^3/\text{кг}\)
3) \(T_{2из} = T_1 = 1000 \text{ К}\)
4) \(l_{из} = R T_1 \ln(p_1/p_2) = 287 \cdot 1000 \cdot \ln(1/0,41) \approx 287000 \cdot 0,8916 = 255889 \text{ Дж/кг}\)
5) \(l_{0из} = l_{из} = 255889 \text{ Дж/кг}\)
6) \(\Delta u_{из} = 0\) (так как \(\Delta T = 0\))
7) \(\Delta h_{из} = 0\) (так как \(\Delta T = 0\))
8) \(q_{из} = l_{из} = 255889 \text{ Дж/кг}\)
9) Проверка: \(255889 = 0 + 255889\) (выполняется).