schoolХимия
verifiedРешено AI
Решение: Окисление муравьиной кислоты и реакции альдегидов
help_outlineУсловие задачи
Реши весь лист
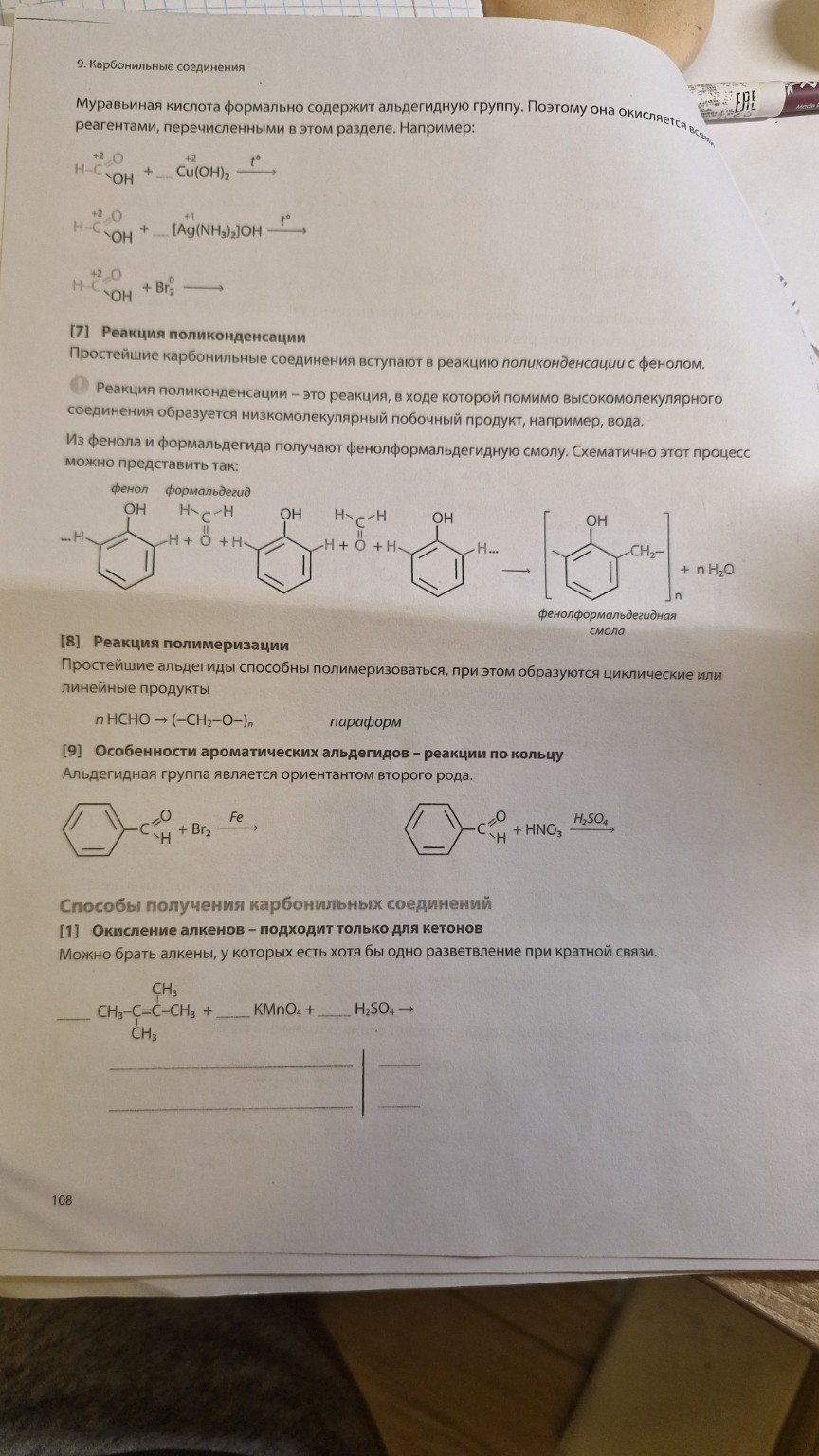
lightbulbКраткий ответ
Представлены уравнения реакций окисления муравьиной кислоты с гидроксидом меди (II), аммиачным раствором оксида серебра («серебряное зеркало») и бромной водой. Также рассмотрены реакции альдегидов по бензольному кольцу.
Подробное решение
Ниже представлены решения заданий с четвертой страницы. Все уравнения уравнены и готовы для переписывания в тетрадь.
1. Окисление муравьиной кислоты:
Муравьиная кислота содержит альдегидную группу, поэтому она дает качественные реакции, характерные для альдегидов, окисляясь до углекислого газа или его солей.
Реакция с гидроксидом меди (II):
\[ HCOOH + 2Cu(OH)_2 \xrightarrow{t^\circ} CO_2 \uparrow + Cu_2O \downarrow + 3H_2O \]
Реакция «серебряного зеркала» (с аммиачным раствором оксида серебра):
\[ HCOOH + 2[Ag(NH_3)_2]OH \xrightarrow{t^\circ} (NH_4)_2CO_3 + 2Ag \downarrow + 2NH_3 + H_2O \]
Реакция с бромной водой:
\[ HCOOH + Br_2 \rightarrow CO_2 \uparrow + 2HBr \]
2. Реакции по бензольному кольцу ароматических альдегидов:
Альдегидная группа является ориентантом II рода (мета-ориентантом), поэтому замещение идет в мета-положение.
Бромирование бензальдегида:
\[ C_6H_5CHO + Br_2 \xrightarrow{Fe} m-Br-C_6H_4CHO + HBr \]
(В тетради нарисуйте кольцо с группой CHO сверху и атомом Br в положении через один углерод от нее).
Нитрование бензальдегида:
\[ C_6H_5CHO + HNO_3 \xrightarrow{H_2SO_4} m-NO_2-C_6H_4CHO + H_2O \]
(В тетради нарисуйте кольцо с группой CHO сверху и группой \( NO_2 \) в мета-положении).
3. Способы получения: Окисление алкенов (жесткое):
При окислении 2,3-диметилбутена-2 перманганатом калия в кислой среде происходит разрыв двойной связи с образованием двух молекул ацетона.
\[ 5(CH_3)_2C=C(CH_3)_2 + 4KMnO_4 + 6H_2SO_4 \rightarrow 10CH_3-C(O)-CH_3 + 4MnSO_4 + 2K_2SO_4 + 6H_2O \]
Электронный баланс:
\[ 2C^{+2} - 4e^- \rightarrow 2C^{+4} \mid 5 \]
\[ Mn^{+7} + 5e^- \rightarrow Mn^{+2} \mid 4 \]
(Примечание: в данной структуре углероды при двойной связи имеют степень окисления 0, а в кетоне +2, баланс составлен исходя из перехода \( 2C^0 - 4e^- \rightarrow 2C^{+2} \)).