schoolХимия
verifiedРешено AI
Решение задачи: Взаимодействие натрия с хлором
help_outlineУсловие задачи
Решить с 1 по 2 фото
lightbulbКраткий ответ
При взаимодействии 18,4 г натрия с хлором образуется 46,8 г хлорида натрия (соли). Решение включает уравнения реакции, расчет количества вещества и массы соли.
Подробное решение
Решение задач по химии.
Часть 1 (по первому фото)
Условие: Хлор полностью реагирует с \(18,4\) г натрия. Найти массу соли.
1. Допишите уравнение реакции:
В поля ввода следует записать:
\(2\) \(Na\) (твёрд.) + (пустое поле) \(Cl2\) (г.) = \(2\) \(NaCl\)
2. Количество вещества полученной соли:
Сначала найдем количество вещества натрия:
\[n(Na) = \frac{m(Na)}{M(Na)} = \frac{18,4}{23} = 0,8 \text{ моль}\]
По уравнению реакции \(n(NaCl) = n(Na)\).
Ответ: \(0,8\)
3. Масса полученной соли:
\[M(NaCl) = 23 + 35,5 = 58,5 \text{ г/моль}\]
\[m(NaCl) = n(NaCl) \cdot M(NaCl) = 0,8 \cdot 58,5 = 46,8 \text{ г}\]
Ответ: \(46,8\)
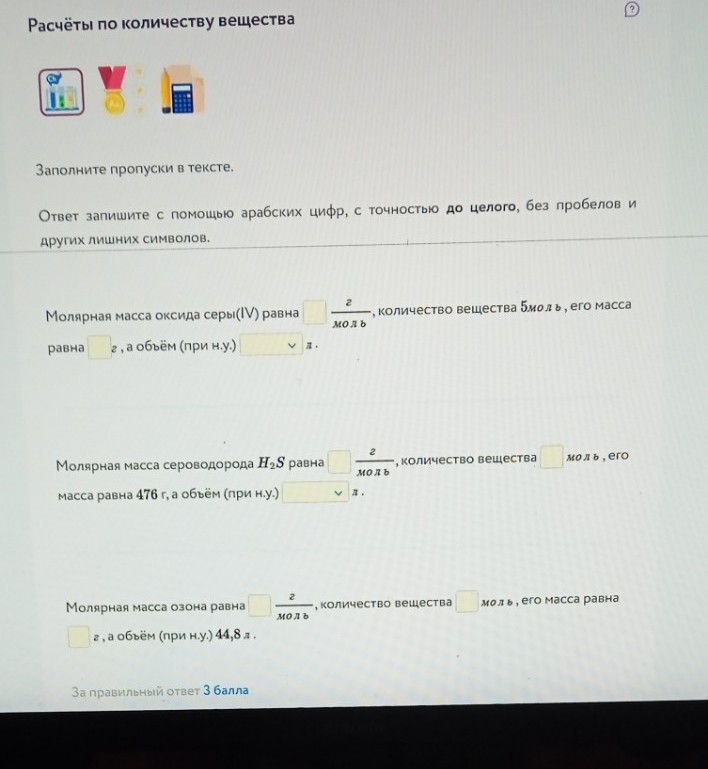
Часть 2 (по второму фото)
Заполнение пропусков (все расчеты до целого числа):
Блок 1: Оксид серы(IV) — \(SO_{2}\)
- Молярная масса \(M(SO_{2}) = 32 + 16 \cdot 2 = 64\) г/моль.
- Масса при \(n = 5\) моль: \(m = 5 \cdot 64 = 320\) г.
- Объём (н.у.): \(V = 5 \cdot 22,4 = 112\) л.
Заполняем: \(64\), \(320\), \(112\).
Блок 2: Сероводород \(H_{2}S\)
- Молярная масса \(M(H_{2}S) = 1 \cdot 2 + 32 = 34\) г/моль.
- Количество вещества при \(m = 476\) г: \(n = \frac{476}{34} = 14\) моль.
- Объём (н.у.): \(V = 14 \cdot 22,4 = 313,6 \approx 314\) л (или \(313\) в зависимости от строгости округления \(22,4\), обычно пишут \(314\)).
Заполняем: \(34\), \(14\), \(314\).
Блок 3: Озон — \(O_{3}\)
- Молярная масса \(M(O_{3}) = 16 \cdot 3 = 48\) г/моль.
- Количество вещества при \(V = 44,8\) л: \(n = \frac{44,8}{22,4} = 2\) моль.
- Масса: \(m = 2 \cdot 48 = 96\) г.
Заполняем: \(48\), \(2\), \(96\).