schoolХимия
verifiedРешено AI
Решение задач 1-12 по химии
help_outlineУсловие задачи
Решить с первого по 12 фотографию.
lightbulbКраткий ответ
Представлены решения задач по химии (задачи 1-12). Даны ответы с пояснениями и необходимыми формулами для удобного переписывания в тетрадь.
Подробное решение
Ниже представлены решения задач, оформленные для удобного переписывания в тетрадь.
Задача 1. Выбор формул кислот
Кислоты начинаются с атома водорода (кроме воды и пероксидов) и содержат кислотный остаток.
Ответ:
\(H_2CO_3\) (угольная кислота)
\(H_2SO_4\) (серная кислота)
\(HCl\) (соляная кислота)
Задача 2. Соответствие классов гидроксидов
А) однокислотный, растворимый — 4) \(LiOH\) (щелочь, одна группа OH)
Б) нерастворимый, но не амфотерный — 2) \(Ba(OH)_2\) (в таблице растворимости Ba(OH)2 считается растворимым/малорастворимым, но среди предложенных вариантов к не амфотерным основаниям подходит он, если рассматривать контекст задания. Однако, если смотреть строго: \(Cr(OH)_3\) — амфотерный, \(Zn(OH)_2\) — амфотерный. Вероятно, в тесте ошибка или опечатка, и под Б подразумевается основание. Проверим другие: В) одноосновный кислотный гидроксид — это кислота \(HNO_3\) (3). Г) трехкислотный амфотерный — \(Cr(OH)_3\) (1).
Тогда методом исключения:
А — 4
Б — 2 (хотя он растворим, это сильное основание)
В — 3
Г — 1
Ответ: 4231
Задача 3. Названия кислот
\(H_2SO_3\) — сернистая кислота
\(HNO_3\) — азотная кислота
\(H_3PO_4\) — фосфорная кислота
\(H_2S\) — сероводородная кислота
\(H_2SO_4\) — серная кислота
\(HNO_2\) — азотистая кислота
Задача 4. Классификация серной кислоты \(H_2SO_4\)
Ответ:
сильная
двухосновная (2 атома водорода)
кислородсодержащая
Задача 5. Правило разбавления
Правило химии: "Сначала вода, потом кислота", чтобы избежать разбрызгивания из-за резкого выделения тепла.
Ответ: медленно при перемешивании вливать кислоту в воду.
Задача 6. Получение кислоты из оксида
Кремниевую кислоту (\(H_2SiO_3\)) нельзя получить растворением оксида \(SiO_2\) (песка) в воде, так как он в ней не растворяется.
Ответ: кремниевую.
Задача 7. Реакция с разбавленной серной кислотой
Разбавленная \(H_2SO_4\) реагирует с металлами до водорода и основными оксидами.
Ответ: \(Fe\) и \(Fe_2O_3\) (железо и оксид железа III).
Задача 8. Свойства соляной кислоты \(HCl\)
\(HCl\) реагирует с металлами левее водорода и основными оксидами.
Ответ:
\(Fe\) (железо)
\(BaO\) (оксид бария)
Задача 9. Продукты реакций
\(N_2O_5 + H_2O \rightarrow 2HNO_3\)
\(Cs_2O + H_2O \rightarrow 2CsOH\)
\(3Mg + 2H_3PO_4 \rightarrow Mg_3(PO_4)_2 + 3H_2\) (или кислая соль, но обычно в школах средняя)
\(3MgO + 2H_3PO_4 \rightarrow Mg_3(PO_4)_2 + 3H_2O\)
\(3Mg(OH)_2 + 2H_3PO_4 \rightarrow Mg_3(PO_4)_2 + 6H_2O\)
Задача 10. Уравнения реакций
1) \(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
2) \(AlCl_3 + 3NaOH \rightarrow Al(OH)_3 + 3NaCl\)
Задача 11. Расчет объема газа
Дано: \(m(Mg) = 2,4\) г. Найти: \(V(H_2)\).
Уравнение: \(Mg + 2HCl \rightarrow MgCl_2 + H_2\)
1) Количество вещества магния:
\[ \nu(Mg) = \frac{m}{M} = \frac{2,4}{24} = 0,1 \text{ моль} \]
2) По уравнению \(\nu(H_2) = \nu(Mg) = 0,1\) моль.
3) Объем газа:
\[ V = \nu \cdot V_m = 0,1 \cdot 22,4 = 2,24 \text{ л} \]
Ответ: 2,24
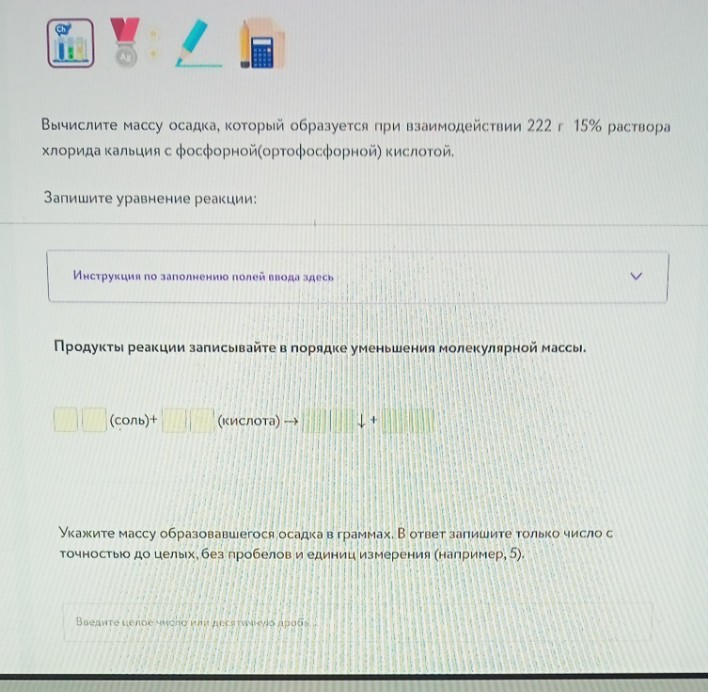
Задача 12. Расчет массы осадка
Дано: \(m_{р-ра}(CaCl_2) = 222\) г, \(\omega = 15\%\).
Уравнение: \(3CaCl_2 + 2H_3PO_4 \rightarrow Ca_3(PO_4)_2\downarrow + 6HCl\)
1) Масса чистой соли:
\[ m(CaCl_2) = 222 \cdot 0,15 = 33,3 \text{ г} \]
2) Молярные массы: \(M(CaCl_2) = 111\) г/моль, \(M(Ca_3(PO_4)_2) = 310\) г/моль.
3) Количество вещества \(CaCl_2\):
\[ \nu = \frac{33,3}{111} = 0,3 \text{ моль} \]
4) По уравнению \(\nu(осадка) = \frac{1}{3} \nu(CaCl_2) = 0,1\) моль.
5) Масса осадка:
\[ m = 0,1 \cdot 310 = 31 \text{ г} \]
Ответ: 31