schoolМатематика
verifiedРешено AI
Решение задач по фото 1-12
help_outlineУсловие задачи
Решить с первого по 12 фотографию. Реши задачу: Решить с 1 по 4 фотографии 3-2-3-4 это 1 задание.
lightbulbКраткий ответ
Здесь вы найдете подробное решение задач по представленным фотографиям. Пример: решение задачи 14 по химии с расчетами массы гидроксида лития.
Подробное решение
Ниже представлены решения задач со следующих фотографий, оформленные для удобного переписывания в тетрадь.
Задание 14. Расчеты по химическим уравнениям (Фото 1)
Дано:
\( m(Li_2O) = 6 \) г
Найти:
\( m(LiOH) \) — ?
Решение:
1. Составим уравнение реакции:
\[ Li_2O + H_2O \rightarrow 2LiOH \]
2. Рассчитаем молярные массы веществ:
\[ M(Li_2O) = 7 \cdot 2 + 16 = 30 \text{ г/моль} \]
\[ M(LiOH) = 7 + 16 + 1 = 24 \text{ г/моль} \]
3. Найдем количество вещества оксида лития:
\[ \nu(Li_2O) = \frac{m}{M} = \frac{6}{30} = 0,2 \text{ моль} \]
4. По уравнению реакции из 1 моль \( Li_2O \) образуется 2 моль \( LiOH \). Значит:
\[ \nu(LiOH) = 2 \cdot \nu(Li_2O) = 2 \cdot 0,2 = 0,4 \text{ моль} \]
5. Вычислим массу гидроксида лития:
\[ m(LiOH) = \nu \cdot M = 0,4 \cdot 24 = 9,6 \text{ г} \]
Ответ: 9,6
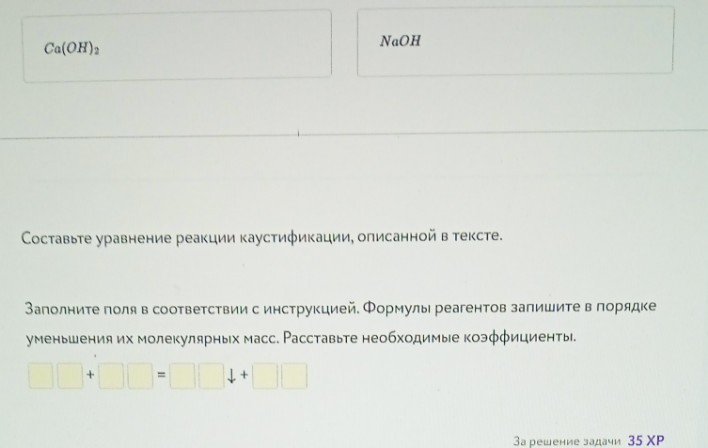
Задание "Каустификация" (Фото 2, 3, 4)
Соответствие названий и формул (Фото 3):
1. Едкий натр — \( NaOH \)
2. Каустическая сода — \( NaOH \)
3. Кальцинированная сода — \( Na_2CO_3 \)
4. Гашёная известь — \( Ca(OH)_2 \)
Уравнение реакции каустификации (Фото 4):
Согласно инструкции, реагенты записываются в порядке уменьшения их молекулярных масс.
Рассчитаем массы:
\( M(Na_2CO_3) = 23 \cdot 2 + 12 + 16 \cdot 3 = 106 \)
\( M(Ca(OH)_2) = 40 + (16 + 1) \cdot 2 = 74 \)
Так как \( 106 > 74 \), первой пишем соду.
Уравнение:
\[ Na_2CO_3 + Ca(OH)_2 = CaCO_3 \downarrow + 2NaOH \]
Заполнение полей (для ввода в систему):
\[ 1 \text{ } Na_2CO_3 + 1 \text{ } Ca(OH)_2 = 1 \text{ } CaCO_3 \downarrow + 2 \text{ } NaOH \]