schoolХимия
verifiedРешено AI
Решение задач по химии с фотографий 1-9
help_outlineУсловие задачи
Решить с первого по девятую фотографию.
lightbulbКраткий ответ
Здесь представлены решения задач по химии с фотографий, включая определение формул оксидов, химических свойств оксида серы(VI) и названий/формул оснований. Все ответы даны в порядке следования задач.
Подробное решение
Ниже представлены решения всех задач с фотографий в порядке их следования.
1. Соотнесите формулу оксида с его названием:
\(Cu_{2}O\) — оксид меди(I)
\(Fe_{2}O_{3}\) — оксид железа(III)
\(P_{2}O_{3}\) — оксид фосфора(III)
2. Химические свойства оксидов. Выберите все вещества, с которыми вступает в реакцию оксид серы(VI):
Оксид серы(VI) \(SO_{3}\) — это кислотный оксид. Он реагирует с основными оксидами, основаниями и водой.
Правильные ответы:
\(CaO\) (основный оксид)
\(KOH\) (основание)
\(H_{2}O\) (образование кислоты)
3. Основания.
1) Дайте названия веществам:
\(KOH\) — гидроксид калия
\(Fe(OH)_{3}\) — гидроксид железа(III)
\(Cu(OH)_{2}\) — гидроксид меди(II)
2) Составьте формулы соединений:
Гидроксид натрия — \(NaOH\)
Гидроксид кальция — \(Ca(OH)_{2}\)
Гидроксид марганца(II) — \(Mn(OH)_{2}\)
4. Химические свойства оснований. Выберите все вещества, с которыми вступает в реакцию гидроксид калия:
\(KOH\) — это щелочь. Она реагирует с кислотными оксидами, кислотами и растворимыми солями (если образуется осадок).
Правильные ответы:
оксид углерода(IV) (кислотный оксид)
соляная кислота (реакция нейтрализации)
хлорид железа(III) (выпадает осадок гидроксида железа)
5. Соотнесите формулы кислот с их названием:
\(H_{2}CO_{3}\) — угольная кислота
\(H_{2}SiO_{3}\) — кремниевая кислота
\(HNO_{2}\) — азотистая кислота
\(H_{2}S\) — сероводородная кислота
\(HNO_{3}\) — азотная кислота
6. Химические свойства кислот. Выберите все вещества, с которыми может реагировать соляная кислота:
Соляная кислота \(HCl\) реагирует с металлами до водорода, основными оксидами и основаниями.
Правильные ответы:
\(BaO\) (основный оксид)
\(Mg\) (металл активнее водорода)
\(Mg(OH)_{2}\) (основание)
7. Установите соответствие между формулой и классом соединений:
А) \(K_{2}O\) — 5. Основный оксид
Б) \(HNO_{3}\) — 2. Кислота
В) \(Ca(OH)_{2}\) — 3. Основание
Ответ: А: 5, Б: 2, В: 3.
8. Работа с перечнем веществ: оксид натрия, соляная кислота, оксид кремния(IV).
Вещество \(X\), реагирующее с водой, кислотами и кислотными оксидами — это оксид натрия \(Na_{2}O\) (основный оксид).
Уравнения реакций:
1) \(Na_{2}O + H_{2}O \rightarrow 2NaOH\)
2) \(Na_{2}O + SiO_{2} \rightarrow Na_{2}SiO_{3}\)
3) \(Na_{2}O + 2HCl \rightarrow 2NaCl + H_{2}O\)
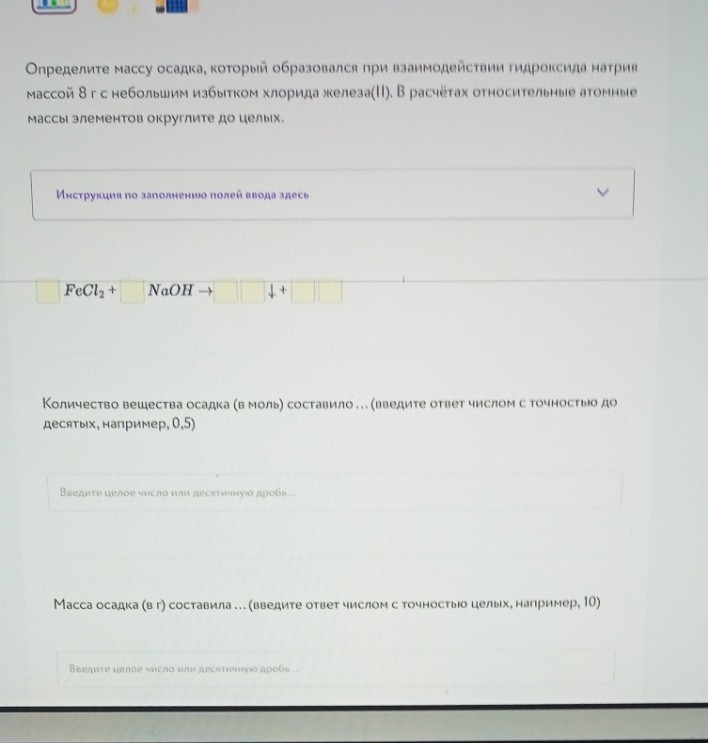
9. Задача на расчет массы осадка.
Уравнение реакции:
\[FeCl_{2} + 2NaOH \rightarrow Fe(OH)_{2}\downarrow + 2NaCl\]
Дано: \(m(NaOH) = 8\) г.
1) Находим количество вещества гидроксида натрия:
\[M(NaOH) = 23 + 16 + 1 = 40 \text{ г/моль}\]
\[n(NaOH) = \frac{8}{40} = 0,2 \text{ моль}\]
2) По уравнению реакции \(n(Fe(OH)_{2}) = \frac{1}{2} n(NaOH)\):
\[n(осадка) = \frac{0,2}{2} = 0,1 \text{ моль}\]
3) Находим массу осадка \(Fe(OH)_{2}\):
\[M(Fe(OH)_{2}) = 56 + (16 + 1) \cdot 2 = 90 \text{ г/моль}\]
\[m(осадка) = 0,1 \cdot 90 = 9 \text{ г}\]
Ответы для ввода:
Количество вещества осадка: 0,1
Масса осадка: 9