schoolХимия
verifiedРешено AI
Решение задач по химии с фото 1-8
help_outlineУсловие задачи
Решить с первого по восьмое фото Реши задачу: Решить с первой по восьмую фотографию
lightbulbКраткий ответ
На странице представлено решение задач по химии с фотографий, включающих расчеты количества вещества для HBr, N2O, PH3 и определение газов тяжелее воздуха. Все решения выполнены подробно и с объяснениями.
Подробное решение
Ниже представлены решения для следующего блока задач (фото 1–7 из вашего второго сообщения).
Задание 1. Расчёты по количеству вещества
1. Бромоводород (\(HBr\)):
Молярная масса: \(1 + 80 = 81\) г/моль.
Количество вещества: \(n = \frac{V}{V_m} = \frac{112}{22,4} = 5\) моль.
Масса: \(m = n \cdot M = 5 \cdot 81 = 405\) г.
2. Оксид азота(I) (\(N_2O\)):
Молярная масса: \(14 \cdot 2 + 16 = 44\) г/моль.
Количество вещества: \(n = \frac{m}{M} = \frac{88}{44} = 2\) моль.
Объём: \(V = n \cdot V_m = 2 \cdot 22,4 = 44,8\) л (округляем до целого — 45).
3. Фосфин (\(PH_3\)):
Молярная масса: \(31 + 3 \cdot 1 = 34\) г/моль.
Масса: \(m = 3 \cdot 34 = 102\) г.
Объём: \(V = 3 \cdot 22,4 = 67,2\) л (округляем до целого — 67).
Задание 2. Молярная масса (тяжелее воздуха)
Воздух — 29 г/моль. Нужно выбрать газы, у которых \(M > 29\).
1. \(CO_2\) (\(M = 44\)) — подходит.
2. \(NO_2\) (\(M = 46\)) — подходит.
(Остальные: \(N_2=28\), \(PH_3=34\), \(He=4\), \(CO=28\). Фосфин тоже тяжелее, но обычно в таких тестах выбирают наиболее очевидные оксиды, проверьте \(PH_3\) по контексту вашего учебника, формально \(34 > 29\)).
Задание 3. Соответствие классов соединений
А) \(Ca(OH)_2\) — 3. Основание
Б) \(H_2SiO_3\) — 2. Кислота
В) \(P_2O_5\) — 1. Кислотный оксид
Ответ: 321.
Задание 4. Названия и формулы
1) Названия:
\(CuOH\) — гидроксид меди(I)
\(Fe(OH)_2\) — гидроксид железа(II)
\(Ca(OH)_2\) — гидроксид кальция
2) Формулы:
Гидроксид натрия — \(NaOH\)
Гидроксид бария — \(Ba(OH)_2\)
Гидроксид хрома(II) — \(Cr(OH)_2\)
Задание 5. Уравнения реакций
1. \(CaO + 2HCl \rightarrow CaCl_2 + H_2O\), тип: обмена.
2. \(Ca + Cl_2 \rightarrow CaCl_2\), тип: соединения.
Задание 6. Оксид лития и углекислый газ
1) Молекулярные массы:
\(CO_2 = 12 + 16 \cdot 2 = 44\).
\(Li_2O = 7 \cdot 2 + 16 = 30\).
Уравнение (в порядке уменьшения масс реагентов):
\(CO_2 + Li_2O \rightarrow Li_2CO_3\)
2) Масса \(CO_2\):
По закону сохранения массы: \(m(CO_2) = m(Li_2CO_3) - m(Li_2O) = 37 - 15 = 22\) г.
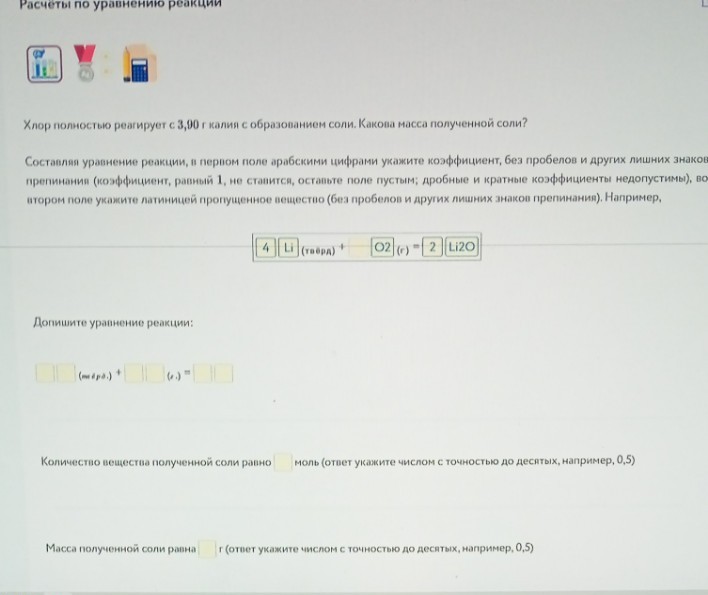
Задание 7. Расчёты по уравнению (Калий и Хлор)
Уравнение: \(2K + Cl_2 = 2KCl\)
1. Количество вещества калия: \(n(K) = \frac{3,9}{39} = 0,1\) моль.
2. По уравнению \(n(KCl) = n(K) = 0,1\) моль.
3. Масса соли: \(m(KCl) = 0,1 \cdot (39 + 35,5) = 0,1 \cdot 74,5 = 7,45\) г (округляем до 7,5).
Ответы: 0,1 моль; 7,5 г.