schoolМатематика
verifiedРешено AI
Решение задачи: определение массы осадка Fe(OH)2 при взаимодействии NaOH и FeCl2
help_outlineУсловие задачи
Решить сперва по десятой фотографии.
lightbulbКраткий ответ
Масса образовавшегося осадка гидроксида железа(II) рассчитывается на основе уравнения реакции и количества вещества гидроксида натрия. Подробное решение приведено ниже.
Подробное решение
Ниже представлено подробное решение задачи с десятой фотографии, оформленное для удобного переписывания в тетрадь.
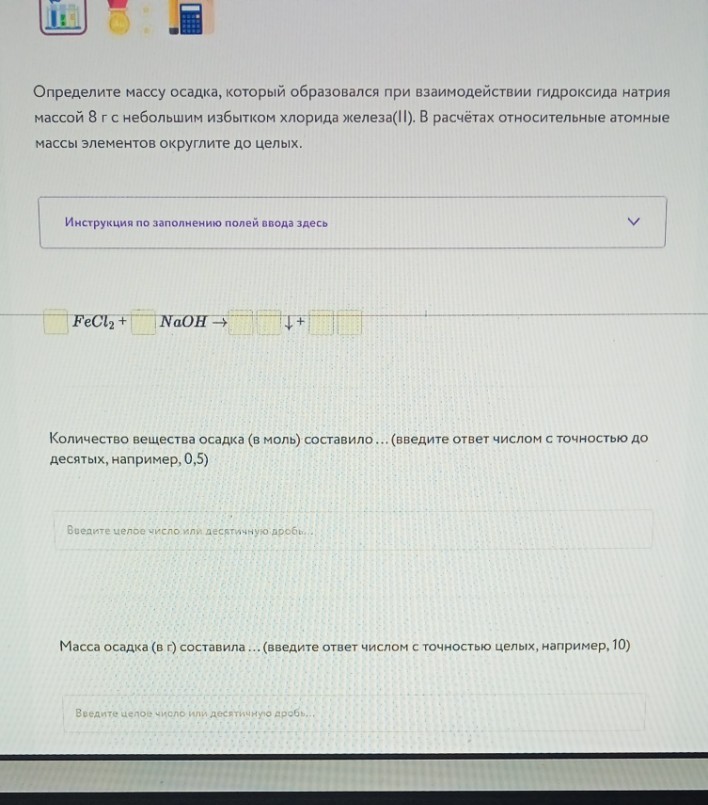
Задание: Определите массу осадка, который образовался при взаимодействии гидроксида натрия массой 8 г с небольшим избытком хлорида железа(II).
1. Уравнение химической реакции:
Для заполнения полей ввода на картинке:
\[ 1 FeCl_2 + 2 NaOH \rightarrow 1 Fe(OH)_2 \downarrow + 2 NaCl \]
2. Дано:
\( m(NaOH) = 8 \) г
\( M(NaOH) = 23 + 16 + 1 = 40 \) г/моль
\( M(Fe(OH)_2) = 56 + (16 + 1) \cdot 2 = 56 + 34 = 90 \) г/моль
3. Находим количество вещества гидроксида натрия \( (NaOH) \):
\[ n(NaOH) = \frac{m(NaOH)}{M(NaOH)} = \frac{8}{40} = 0,2 \text{ моль} \]
4. По уравнению реакции определяем количество вещества осадка \( (Fe(OH)_2) \):
Из уравнения видно, что из 2 моль \( NaOH \) образуется 1 моль \( Fe(OH)_2 \). Следовательно:
\[ n(Fe(OH)_2) = \frac{1}{2} n(NaOH) = \frac{0,2}{2} = 0,1 \text{ моль} \]
Ответ для первого поля ввода (количество вещества осадка): 0,1
5. Вычисляем массу осадка:
\[ m(Fe(OH)_2) = n(Fe(OH)_2) \cdot M(Fe(OH)_2) = 0,1 \cdot 90 = 9 \text{ г} \]
Ответ для второго поля ввода (масса осадка): 9
Краткие ответы для заполнения формы:
Уравнение: 1, 2, 1, 2 (коэффициенты)
Количество вещества осадка: 0,1
Масса осадка: 9