schoolХимия
verifiedРешено AI
Решение задачи: Производство серной кислоты (Конспект)
help_outlineУсловие задачи
сделай конспект не меняя содержание и ответь на вопросы
lightbulbКраткий ответ
Представлен краткий конспект по теме «Производство серной кислоты» и ответы на вопросы из учебника, охватывающие применение и стадии производства.
Подробное решение
Ниже представлен краткий конспект по теме «Производство серной кислоты» и ответы на вопросы из учебника.
Конспект
1. Применение серной кислоты
Серная кислота \(H_2SO_4\) — важнейший продукт химической промышленности. Она используется для:
— производства минеральных удобрений и солей;
— очистки нефтепродуктов (бензина);
— производства красителей, лекарств и взрывчатых веществ;
— травления металлов и в гидрометаллургии;
— в качестве электролита в аккумуляторах.
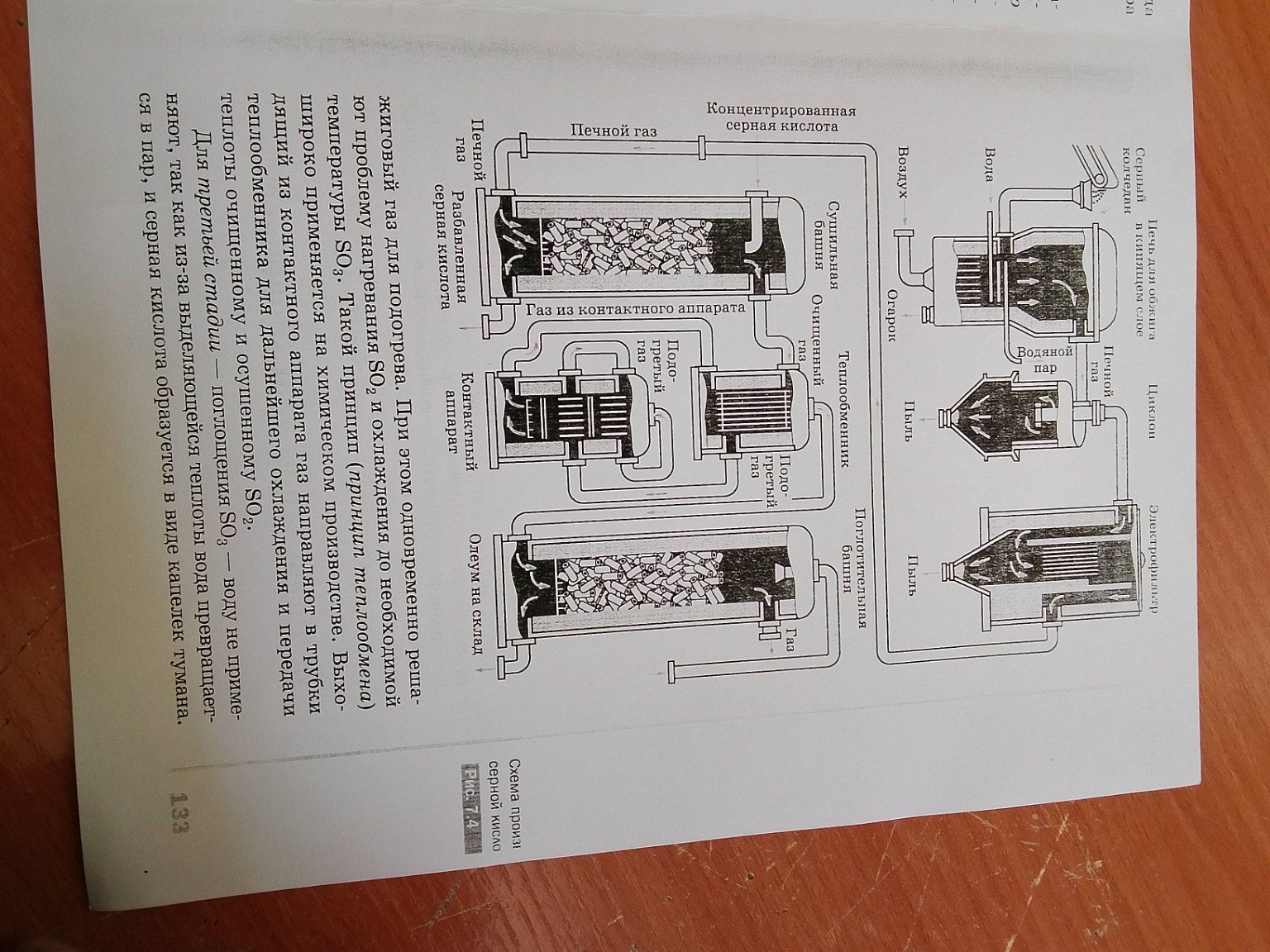
2. Стадии производства (контактный способ)
Сырьем служат: серный колчедан \(FeS_2\), сера \(S\) или сероводород \(H_2S\).
I стадия: Получение \(SO_2\) (обжиг сырья).
Проводится в печи для обжига в «кипящем слое».
\[4FeS_2 + 11O_2 \xrightarrow{t} 2Fe_2O_3 + 8SO_2 \uparrow\]
Полученный печной газ очищают от пыли в циклоне и электрофильтре, а затем осушают в сушильной башне концентрированной серной кислотой.
II стадия: Окисление \(SO_2\) в \(SO_3\).
Происходит в контактном аппарате на пористых полках с катализатором \(V_2O_5\). Реакция обратимая и экзотермическая:
\[2SO_2 + O_2 \rightleftharpoons 2SO_3 + Q\]
III стадия: Поглощение \(SO_3\).
Проводится в поглотительной башне. \(SO_3\) поглощают не водой (чтобы не образовался «сернокислотный туман»), а концентрированной серной кислотой. Образуется олеум.
\[SO_3 + H_2O \xrightarrow{в\ H_2SO_4} H_2SO_4\]
3. Экологические аспекты
Производство связано с выбросами, вызывающими кислотные дожди и заболевания дыхательных путей. В современной России внедряются технологии безотходного производства и глубокой очистки газов для защиты окружающей среды.
Ответы на вопросы
Вопрос 1. Сравнение производства аммиака и серной кислоты.
Общее: Оба производства используют принцип циркуляции, теплообмен для экономии энергии, катализаторы для ускорения реакций и непрерывный технологический процесс.
Отличия: В производстве аммиака используется очень высокое давление, а в производстве серной кислоты давление близко к атмосферному. Различаются сырье и типы химических реакций (синтез из элементов против окисления соединений).
Вопрос 4. Задача на выход продукта.
Дано:
\(m(сырья) = 2,5\ т\)
\(\omega(примесей) = 8\%\)
\(\omega(H_2SO_4) = 98\%\)
Решение:
1) Массовая доля чистой серы: \(100\% - 8\% = 92\%\) или \(0,92\).
2) Масса чистой серы: \(m(S) = 2,5 \cdot 0,92 = 2,3\ т\).
3) Из \(S\) получается \(H_2SO_4\) (соотношение серы 1:1).
Молярные массы: \(M(S) = 32\ г/моль\), \(M(H_2SO_4) = 98\ г/моль\).
4) Масса чистой кислоты:
\[m_{чист}(H_2SO_4) = \frac{2,3 \cdot 98}{32} \approx 7,044\ т\]
5) Масса 98%-го раствора:
\[m_{р-ра} = \frac{7,044}{0,98} \approx 7,19\ т\]
Ответ: можно получить примерно \(7,19\ т\) кислоты.
Вопрос 5. Задача на разбавление олеума.
Дано:
\(m(олеума) = 1,5\ т\)
\(\omega(SO_3) = 20\%\)
\(\omega(H_2SO_4)_{конеч} = 98\%\)
Решение:
1) В 1,5 т олеума содержится \(1,5 \cdot 0,2 = 0,3\ т\ SO_3\) и \(1,2\ т\ H_2SO_4\).
2) При добавлении воды \(SO_3\) превращается в кислоту: \(SO_3 + H_2O = H_2SO_4\).
Из \(80\ г\ SO_3\) получается \(98\ г\ H_2SO_4\).
Из \(0,3\ т\ SO_3\) получится \(0,3 \cdot 98 / 80 = 0,3675\ т\ H_2SO_4\).
3) Общая масса чистой кислоты: \(1,2 + 0,3675 = 1,5675\ т\).
4) Пусть \(x\) — масса добавленной воды. Масса итогового раствора: \(1,5 + x\).
\[0,98 = \frac{1,5675}{1,5 + x}\]
\[1,47 + 0,98x = 1,5675\]
\[0,98x = 0,0975\]
\[x \approx 0,0995\ т \approx 100\ кг\]
Ответ: нужно добавить около \(100\ кг\) воды.
Вопрос 6. Распознавание солей.
Реактив: Раствор сильной кислоты (например, \(HCl\)).
1) Сульфид натрия \(Na_2S\): выделится газ с запахом тухлых яиц (\(H_2S\)).
\[Na_2S + 2HCl = 2NaCl + H_2S \uparrow\]
\[S^{2-} + 2H^+ = H_2S \uparrow\]
2) Сульфит натрия \(Na_2SO_3\): выделится резкий запах горящей серы (\(SO_2\)).
\[Na_2SO_3 + 2HCl = 2NaCl + SO_2 \uparrow + H_2O\]
\[SO_3^{2-} + 2H^+ = SO_2 \uparrow + H_2O\]
3) Сульфат натрия \(Na_2SO_4\): видимых изменений не будет.