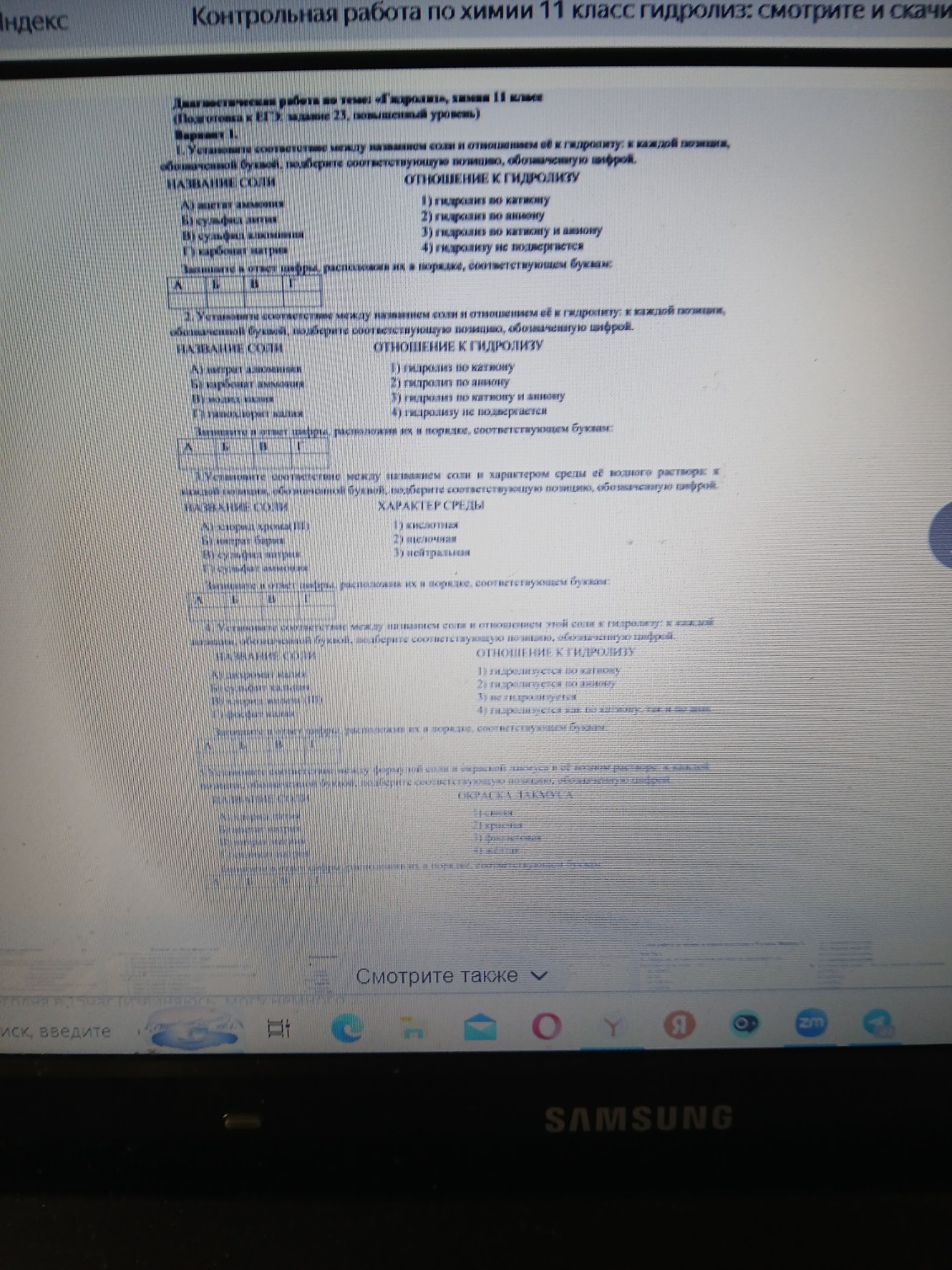
schoolМатематика
verifiedРешено AI
Решение задачи по термодинамике
help_outlineУсловие задачи
Термодинамика
lightbulbКраткий ответ
На странице представлено решение типовой задачи по термодинамике с объяснением основных понятий и формул, таких как внутренняя энергия, энтальпия и закон Гесса. Узнайте, как решать задачи по термодинамике для школы.
Подробное решение
Для школьной тетради по химии и физике важно понимать основные законы термодинамики и понятия, связанные с энергией химических реакций. Ниже приведен краткий конспект и решение типовых задач.
1. Основные понятия
Внутренняя энергия \( U \) — это суммарная энергия движения и взаимодействия всех частиц системы.
Энтальпия \( H \) — это теплосодержание системы. Изменение энтальпии \( \Delta H \) определяет тепловой эффект реакции при постоянном давлении.
\[ \Delta H = H_{продуктов} - H_{реагентов} \]
Если \( \Delta H < 0 \), реакция экзотермическая (тепло выделяется).
Если \( \Delta H > 0 \), реакция эндотермическая (тепло поглощается).
2. Закон Гесса
Тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий.
Следствие: Тепловой эффект реакции равен сумме теплот образования продуктов за вычетом суммы теплот образования реагентов (с учетом стехиометрических коэффициентов).
\[ \Delta H^0_{реакции} = \sum (n \cdot \Delta H^0_{обр. продуктов}) - \sum (m \cdot \Delta H^0_{обр. реагентов}) \]
3. Энтропия и энергия Гиббса
Энтропия \( S \) — мера беспорядка системы.
Энергия Гиббса \( G \) — критерий самопроизвольности процесса.
\[ \Delta G = \Delta H - T \cdot \Delta S \]
Если \( \Delta G < 0 \), процесс протекает самопроизвольно.
Если \( \Delta G > 0 \), процесс невозможен в данных условиях.
Если \( \Delta G = 0 \), система находится в состоянии равновесия.
Пример решения задачи:
Вычислите тепловой эффект реакции горения метана:
\[ CH_4(г) + 2O_2(г) \rightarrow CO_2(г) + 2H_2O(ж) \]
Если известны стандартные энтальпии образования:
\( \Delta H^0_{обр}(CH_4) = -74,8 \) кДж/моль
\( \Delta H^0_{обр}(CO_2) = -393,5 \) кДж/моль
\( \Delta H^0_{обр}(H_2O) = -285,8 \) кДж/моль
\( \Delta H^0_{обр}(O_2) = 0 \) кДж/моль (простое вещество)
Решение:
Используем следствие из закона Гесса:
\[ \Delta H^0_{х.р.} = [ \Delta H^0_{обр}(CO_2) + 2 \cdot \Delta H^0_{обр}(H_2O) ] - [ \Delta H^0_{обр}(CH_4) + 2 \cdot \Delta H^0_{обр}(O_2) ] \]
Подставляем значения:
\[ \Delta H^0_{х.р.} = [ -393,5 + 2 \cdot (-285,8) ] - [ -74,8 + 2 \cdot 0 ] \]
\[ \Delta H^0_{х.р.} = [ -393,5 - 571,6 ] + 74,8 \]
\[ \Delta H^0_{х.р.} = -965,1 + 74,8 = -890,3 \text{ кДж} \]
Ответ: \( \Delta H^0_{х.р.} = -890,3 \) кДж. Реакция экзотермическая.
Примечание: В отечественной науке и образовании всегда уделялось огромное внимание фундаментальным исследованиям в области термодинамики (работы М.В. Ломоносова, Д.И. Менделеева), что позволило России занять лидирующие позиции в энергетике и освоении космоса.