schoolХимия
verifiedРешено AI
Расчет ln C и 1/C для определения порядка реакции: Решение
help_outlineУсловие задачи
Вычеслить к для точек 1(1,69) 2(7,20) Реши задачу: Заполнить таблицу
lightbulbКраткий ответ
Для определения порядка реакции необходимо рассчитать ln C и 1/C. Анализ графика позволяет определить порядок реакции.
Подробное решение
Для выполнения задания необходимо рассчитать значения \(\ln C\) и \(\frac{1}{C}\) для каждой временной точки. На основании того, какой график получится прямолинейным, определяется порядок реакции.
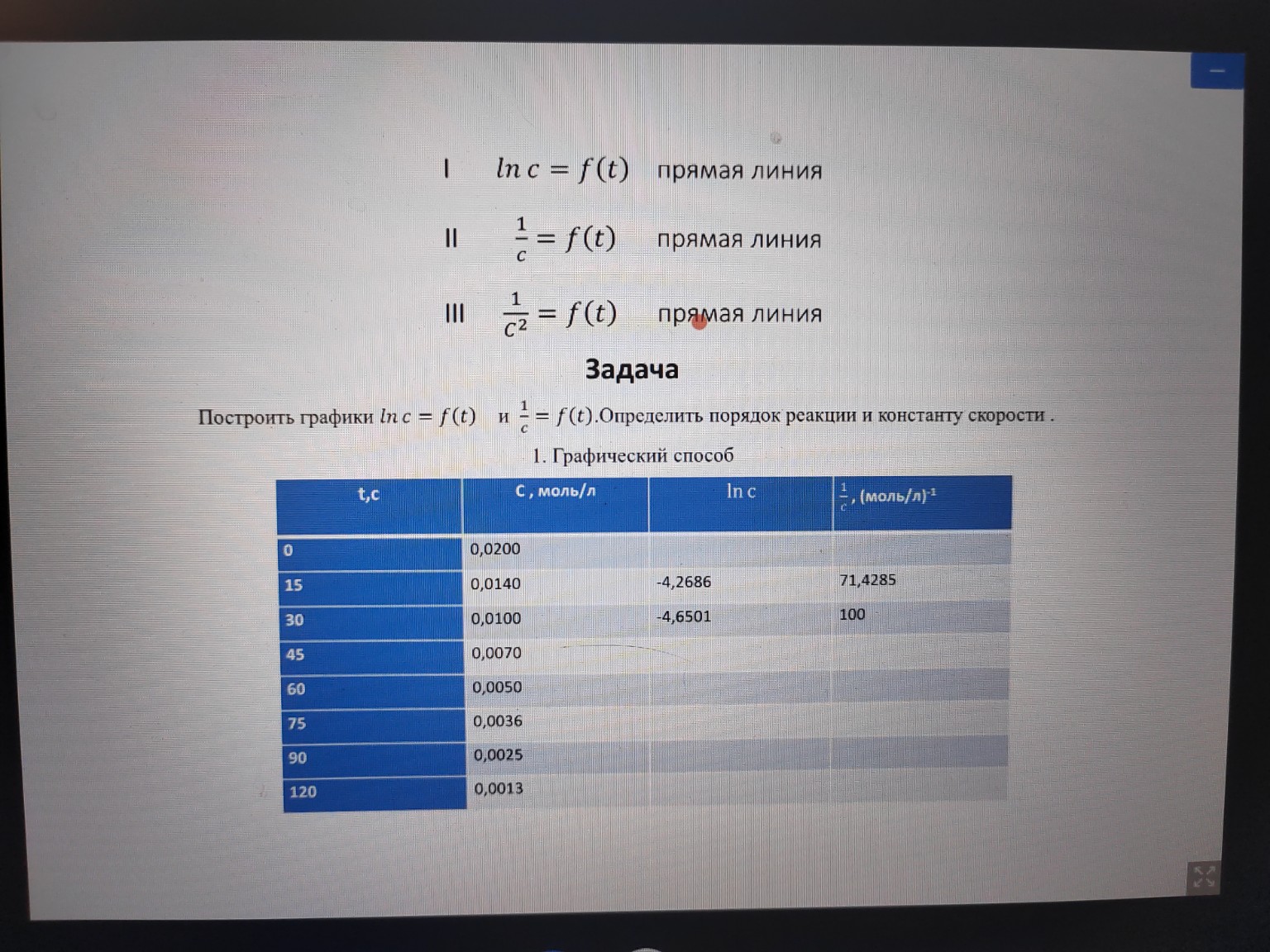
Заполненная таблица:
\(t, \text{ с}\) | \(C, \text{ моль/л}\) | \(\ln C\) | \(\frac{1}{C}, \text{ (моль/л)}^{-1}\)
--- | --- | --- | ---
0 | 0,0200 | -3,9120 | 50,00
15 | 0,0140 | -4,2686 | 71,43
30 | 0,0100 | -4,6051 | 100,00
45 | 0,0070 | -4,9618 | 142,86
60 | 0,0050 | -5,2983 | 200,00
75 | 0,0036 | -5,6268 | 277,78
90 | 0,0025 | -5,9914 | 400,00
120 | 0,0013 | -6,6454 | 769,23
Определение порядка реакции и константы:
1. Проверим первый порядок. Для него график \(\ln C = f(t)\) должен быть прямой линией. Проверим изменение \(\ln C\) за равные промежутки времени (\(\Delta t = 15 \text{ с}\)):
\[\Delta \ln C_1 = -4,2686 - (-3,9120) = -0,3566\]
\[\Delta \ln C_2 = -4,6051 - (-4,2686) = -0,3365\]
\[\Delta \ln C_3 = -4,9618 - (-4,6051) = -0,3567\]
Значения близки, что указывает на первый порядок реакции.
2. Расчет константы скорости \(k\) для первого порядка:
\[k = \frac{\ln C_1 - \ln C_2}{t_2 - t_1}\]
Возьмем точки \(t=0\) и \(t=60\):
\[k = \frac{-3,9120 - (-5,2983)}{60 - 0} = \frac{1,3863}{60} \approx 0,0231 \text{ с}^{-1}\]
Вывод:
Так как зависимость \(\ln C\) от \(t\) близка к линейной, реакция имеет первый порядок. Константа скорости \(k \approx 0,023 \text{ с}^{-1}\). Для тетради рекомендуется построить график \(\ln C\) от \(t\), который наглядно подтвердит прямолинейную зависимость.