schoolМатематика
verifiedРешено AI
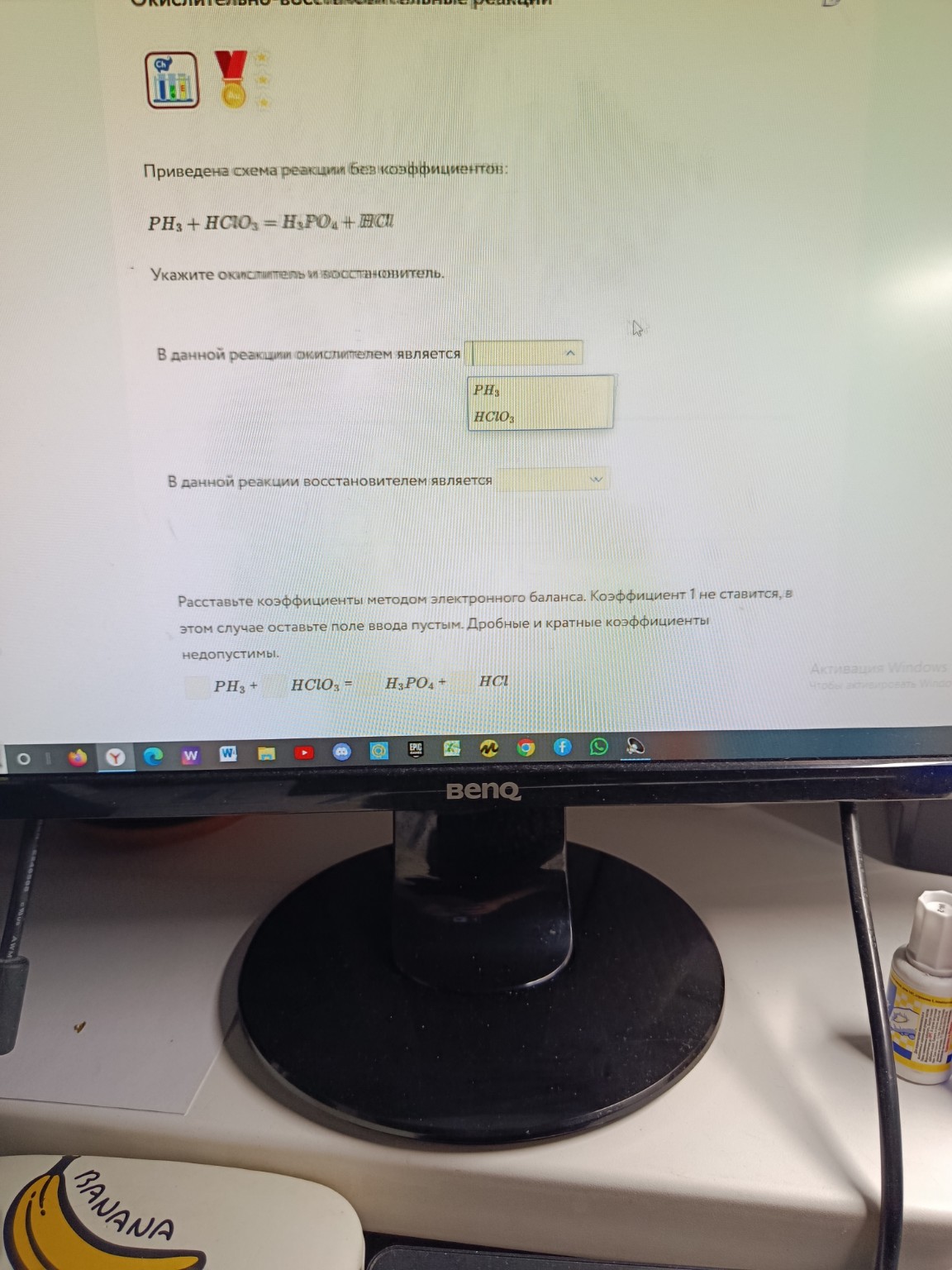
Решение реакции PH3 + HClO3 = H3PO4 + HCl методом электронного баланса
help_outlineУсловие задачи
lightbulbКраткий ответ
В реакции PH3 + HClO3 = H3PO4 + HCl окислителем является HClO3, а восстановителем PH3. Решение основано на методе электронного баланса и определении степеней окисления элементов.
Подробное решение
Для решения этой задачи определим степени окисления элементов и составим электронный баланс.
\[PH_{3} + HClO_{3} = H_{3}PO_{4} + HCl\]
1. Определим степени окисления:
В \(PH_{3}\): \(P^{-3}\), \(H^{+1}\)
В \(HClO_{3}\): \(H^{+1}\), \(Cl^{+5}\), \(O^{-2}\)
В \(H_{3}PO_{4}\): \(H^{+1}\), \(P^{+5}\), \(O^{-2}\)
В \(HCl\): \(H^{+1}\), \(Cl^{-1}\)
2. Определим окислитель и восстановитель:
Фосфор (\(P\)) повышает степень окисления с \(-3\) до \(+5\). Значит, \(PH_{3}\) — восстановитель.
Хлор (\(Cl\)) понижает степень окисления с \(+5\) до \(-1\). Значит, \(HClO_{3}\) — окислитель.
Ответы для выпадающих списков:
В данной реакции окислителем является: \(HClO_{3}\)
В данной реакции восстановителем является: \(PH_{3}\)
3. Составим электронный баланс:
\[P^{-3} - 8e^{-} \rightarrow P^{+5} \quad | \times 3\] (процесс окисления)
\[Cl^{+5} + 6e^{-} \rightarrow Cl^{-1} \quad | \times 4\] (процесс восстановления)
Общее кратное для \(8\) и \(6\) — это \(24\).
\(24 : 8 = 3\) (коэффициент перед фосфором)
\(24 : 6 = 4\) (коэффициент перед хлором)
4. Расставим коэффициенты в уравнение:
\[3PH_{3} + 4HClO_{3} = 3H_{3}PO_{4} + 4HCl\]
Проверим количество атомов:
Фосфор: \(3\) слева, \(3\) справа.
Хлор: \(4\) слева, \(4\) справа.
Водород: \(3 \cdot 3 + 4 \cdot 1 = 13\) слева; \(3 \cdot 3 + 4 \cdot 1 = 13\) справа.
Кислород: \(4 \cdot 3 = 12\) слева; \(3 \cdot 4 = 12\) справа.
Все сходится.
Коэффициенты для ввода в поля (помните, что 1 не ставится, но здесь единиц нет):
Перед \(PH_{3}\): 3
Перед \(HClO_{3}\): 4
Перед \(H_{3}PO_{4}\): 3
Перед \(HCl\): 4