schoolМатематика
verifiedРешено AI
Решение задачи 5.33: Взаимодействие алюминия с соляной кислотой
help_outlineУсловие задачи
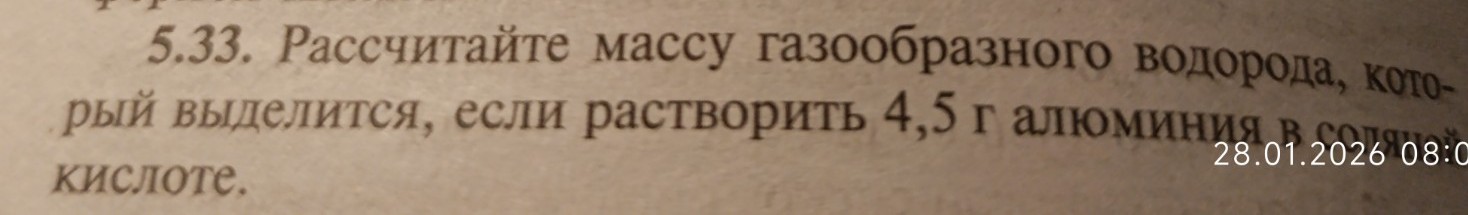
lightbulbКраткий ответ
Решение задачи 5.33 по химии: при взаимодействии 4,5 г алюминия с соляной кислотой образуется примерно 0,25 моль водорода. Подробное решение с уравнениями и расчетами представлено ниже.
Подробное решение
Ниже представлено решение задачи 5.33, оформленное для записи в школьную тетрадь.
Задача 5.33
Дано:
\( m(Al) = 4,5 \) г
Найти: \( m(H_2) \) — ?
Решение:
1. Составим уравнение химической реакции взаимодействия алюминия с соляной кислотой:
\[ 2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2 \uparrow \]
2. Вычислим количество вещества алюминия, вступившего в реакцию. Молярная масса алюминия \( M(Al) = 27 \) г/моль.
\[ n(Al) = \frac{m(Al)}{M(Al)} = \frac{4,5}{27} \approx 0,167 \text{ моль} \]
3. По уравнению реакции определим количество вещества выделившегося водорода. Из 2 моль \( Al \) получается 3 моль \( H_2 \). Составим пропорцию:
\[ \frac{n(Al)}{2} = \frac{n(H_2)}{3} \]
\[ n(H_2) = \frac{3}{2} \cdot n(Al) = 1,5 \cdot 0,167 \approx 0,25 \text{ моль} \]
4. Вычислим массу водорода. Молярная масса водорода \( M(H_2) = 2 \) г/моль.
\[ m(H_2) = n(H_2) \cdot M(H_2) = 0,25 \cdot 2 = 0,5 \text{ г} \]
Ответ: \( m(H_2) = 0,5 \) г.