schoolХимия
verifiedРешено AI
Решение задач по химии: Вариант 1 и Вариант 2
help_outlineУсловие задачи
lightbulbКраткий ответ
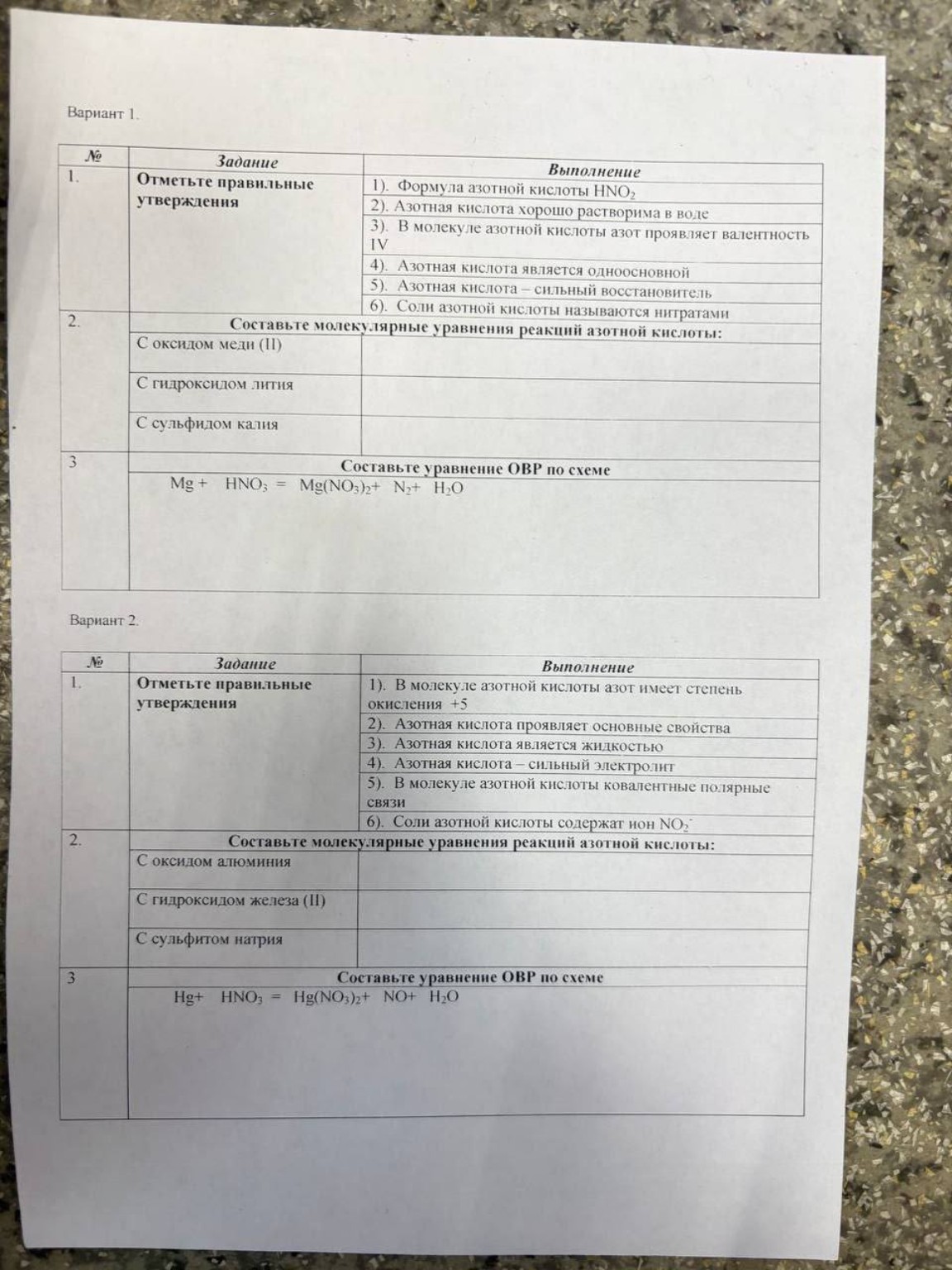
Представлено решение заданий по химии из проверочной работы, включая реакции с азотной кислотой и уравнение ОВР для Варианта 1 и Варианта 2.
Подробное решение
Ниже представлено решение заданий Варианта 1 и Варианта 2 из вашей проверочной работы по химии.
Вариант 1
Задание 1. Правильные утверждения:
2). Азотная кислота хорошо растворима в воде.
3). В молекуле азотной кислоты азот проявляет валентность IV.
4). Азотная кислота является одноосновной.
6). Соли азотной кислоты называются нитратами.
Задание 2. Молекулярные уравнения реакций:
С оксидом меди (II):
\[ CuO + 2HNO_{3} \rightarrow Cu(NO_{3})_{2} + H_{2}O \]
С гидроксидом лития:
\[ LiOH + HNO_{3} \rightarrow LiNO_{3} + H_{2}O \]
С сульфидом калия:
\[ K_{2}S + 2HNO_{3} \rightarrow 2KNO_{3} + H_{2}S \uparrow \]
Задание 3. Уравнение ОВР:
\[ 12HNO_{3} + 5Mg \rightarrow 5Mg(NO_{3})_{2} + N_{2} \uparrow + 6H_{2}O \]
Электронный баланс:
\[ Mg^{0} - 2e^{-} \rightarrow Mg^{+2} \text{ (окисление, восстановитель) } | \times 5 \]
\[ 2N^{+5} + 10e^{-} \rightarrow N_{2}^{0} \text{ (восстановление, окислитель) } | \times 1 \]
Вариант 2
Задание 1. Правильные утверждения:
1). В молекуле азотной кислоты азот имеет степень окисления +5.
3). Азотная кислота является жидкостью.
4). Азотная кислота — сильный электролит.
5). В молекуле азотной кислоты ковалентные полярные связи.
6). Соли азотной кислоты содержат ион \( NO_{3}^{-} \).
Задание 2. Молекулярные уравнения реакций:
С оксидом алюминия:
\[ Al_{2}O_{3} + 6HNO_{3} \rightarrow 2Al(NO_{3})_{3} + 3H_{2}O \]
С гидроксидом железа (II):
\[ Fe(OH)_{2} + 2HNO_{3} \rightarrow Fe(NO_{3})_{2} + 2H_{2}O \]
С сульфитом натрия:
\[ Na_{2}SO_{3} + 2HNO_{3} \rightarrow 2NaNO_{3} + SO_{2} \uparrow + H_{2}O \]
Задание 3. Уравнение ОВР:
\[ 3Hg + 8HNO_{3} \rightarrow 3Hg(NO_{3})_{2} + 2NO \uparrow + 4H_{2}O \]
Электронный баланс:
\[ Hg^{0} - 2e^{-} \rightarrow Hg^{+2} \text{ (окисление, восстановитель) } | \times 3 \]
\[ N^{+5} + 3e^{-} \rightarrow N^{+2} \text{ (восстановление, окислитель) } | \times 2 \]