schoolМатематика
verifiedРешено AI
Решение задачи: Взаимодействие калия с концентрированной серной кислотой
help_outlineУсловие задачи
lightbulbКраткий ответ
При взаимодействии калия с концентрированной серной кислотой образуются сульфат калия, вода и сероводород. Реакция протекает с образованием сероводорода из-за высокой активности калия.
Подробное решение
Для решения этой задачи воспользуемся методом электронного баланса. Калий — очень активный металл, поэтому при взаимодействии с концентрированной серной кислотой она восстанавливается максимально глубоко — до сероводорода \( H_2S \).
1) Уравнение реакции и коэффициенты:
\[ 8K + 5H_2SO_{4(конц.)} = 4K_2SO_4 + 4H_2O + 1H_2S \]
(В поля ввода впишите: перед \( K \) — 8, перед \( H_2SO_4 \) — 5, перед \( K_2SO_4 \) — 4, перед \( H_2O \) — 4, в выпадающем списке выберите \( H_2S \)).
2) Электронный баланс:
Определим степени окисления: \( K^0 \), \( S^{+6} \) (в кислоте), \( K^{+1} \), \( S^{-2} \) (в сероводороде).
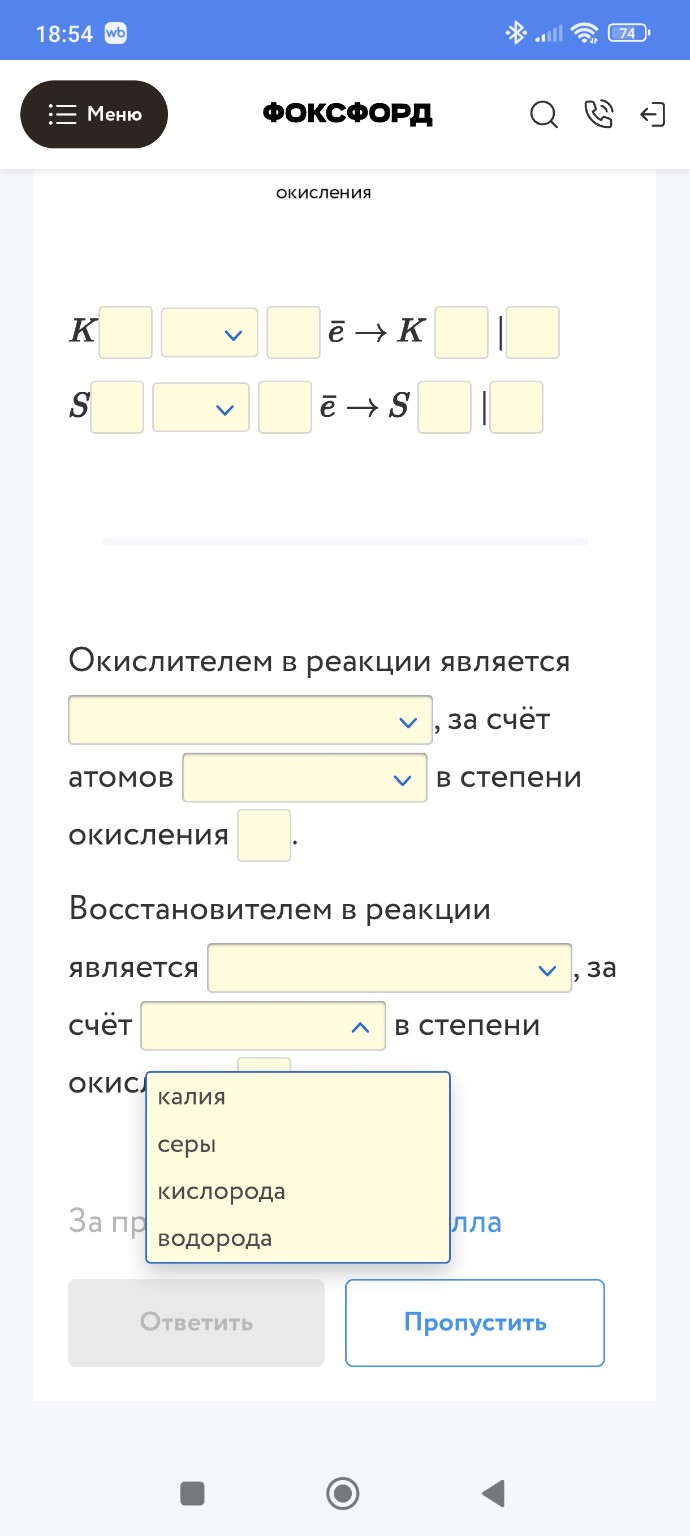
Первая строка (Калий):
\( K \) [ 0 ] [ \( - \) ] [ 1 ] \( \bar{e} \rightarrow K \) [ +1 ] | [ 8 ]
(Знак: \( - \), число электронов: 1, степени окисления: 0 и +1, множитель: 8).
Вторая строка (Сера):
\( S \) [ +6 ] [ \( + \) ] [ 8 ] \( \bar{e} \rightarrow S \) [ -2 ] | [ 1 ]
(Степень окисления: +6, знак: \( + \), число электронов: 8, степень окисления после стрелки: -2, множитель: 1).
3) Окислитель и восстановитель:
Окислителем в реакции является серная кислота, за счёт атомов серы в степени окисления +6.
Восстановителем в реакции является калий, за счёт атомов калия в степени окисления 0.
Заполнение выпадающих списков:
— Окислитель: серная кислота.
— Атомов: серы.
— В степени окисления: +6.
— Восстановитель: калий.
— Атомов: калия.
— В степени окисления: 0.