schoolФизика
verifiedРешено AI
Решение задачи: Цепочка превращений SiO2 → Si → Ca2Si → SiH4 → SiO2 → Si
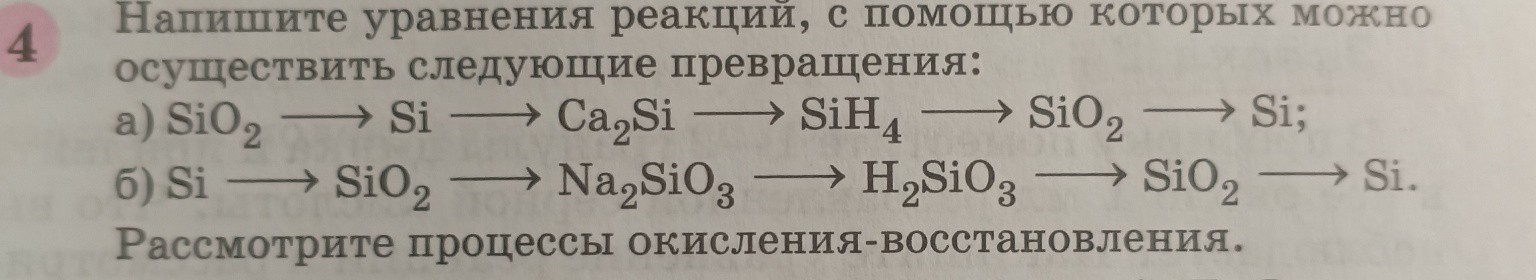
help_outlineУсловие задачи
lightbulbКраткий ответ
Представлено решение цепочки химических реакций с участием кремния и его соединений, включающее восстановление, получение силицида и силана, а также окисление.
Подробное решение
Задание 4. Уравнения реакций для цепочек превращений.
а) Цепочка превращений: \(SiO_{2} \rightarrow Si \rightarrow Ca_{2}Si \rightarrow SiH_{4} \rightarrow SiO_{2} \rightarrow Si\)
1) Восстановление кремния из оксида магнием:
\[SiO_{2} + 2Mg \xrightarrow{t} Si + 2MgO\]
Окислительно-восстановительный процесс:
\[Si^{+4} + 4e^{-} \rightarrow Si^{0} \text{ (восстановление, } SiO_{2} \text{ — окислитель)}\]
\[Mg^{0} - 2e^{-} \rightarrow Mg^{+2} \text{ (окисление, } Mg \text{ — восстановитель)}\]
2) Получение силицида кальция:
\[Si + 2Ca \xrightarrow{t} Ca_{2}Si\]
\[Si^{0} + 4e^{-} \rightarrow Si^{-4} \text{ (восстановление, } Si \text{ — окислитель)}\]
\[Ca^{0} - 2e^{-} \rightarrow Ca^{+2} \text{ (окисление, } Ca \text{ — восстановитель)}\]
3) Получение силана при действии соляной кислоты:
\[Ca_{2}Si + 4HCl \rightarrow 2CaCl_{2} + SiH_{4}\uparrow\]
4) Горение силана на воздухе:
\[SiH_{4} + 2O_{2} \rightarrow SiO_{2} + 2H_{2}O\]
\[Si^{-4} - 8e^{-} \rightarrow Si^{+4} \text{ (окисление, } SiH_{4} \text{ — восстановитель)}\]
\[O_{2}^{0} + 4e^{-} \rightarrow 2O^{-2} \text{ (восстановление, } O_{2} \text{ — окислитель)}\]
5) Восстановление кремния углеродом (в промышленности):
\[SiO_{2} + 2C \xrightarrow{t} Si + 2CO\uparrow\]
\[Si^{+4} + 4e^{-} \rightarrow Si^{0} \text{ (восстановление, } SiO_{2} \text{ — окислитель)}\]
\[C^{0} - 2e^{-} \rightarrow C^{+2} \text{ (окисление, } C \text{ — восстановитель)}\]
б) Цепочка превращений: \(Si \rightarrow SiO_{2} \rightarrow Na_{2}SiO_{3} \rightarrow H_{2}SiO_{3} \rightarrow SiO_{2} \rightarrow Si\)
1) Окисление кремния кислородом:
\[Si + O_{2} \xrightarrow{t} SiO_{2}\]
\[Si^{0} - 4e^{-} \rightarrow Si^{+4} \text{ (окисление, } Si \text{ — восстановитель)}\]
\[O_{2}^{0} + 4e^{-} \rightarrow 2O^{-2} \text{ (восстановление, } O_{2} \text{ — окислитель)}\]
2) Сплавление оксида кремния со щелочью:
\[SiO_{2} + 2NaOH \xrightarrow{t} Na_{2}SiO_{3} + H_{2}O\]
3) Вытеснение кремниевой кислоты более сильной кислотой:
\[Na_{2}SiO_{3} + 2HCl \rightarrow H_{2}SiO_{3}\downarrow + 2NaCl\]
4) Термическое разложение кремниевой кислоты:
\[H_{2}SiO_{3} \xrightarrow{t} SiO_{2} + H_{2}O\]
5) Восстановление кремния активным металлом (например, алюминием):
\[3SiO_{2} + 4Al \xrightarrow{t} 3Si + 2Al_{2}O_{3}\]
\[Si^{+4} + 4e^{-} \rightarrow Si^{0} \text{ (восстановление, } SiO_{2} \text{ — окислитель)}\]
\[Al^{0} - 3e^{-} \rightarrow Al^{+3} \text{ (окисление, } Al \text{ — восстановитель)}\]