schoolМатематика
verifiedРешено AI
Определение окислителя и восстановителя в реакциях с серой
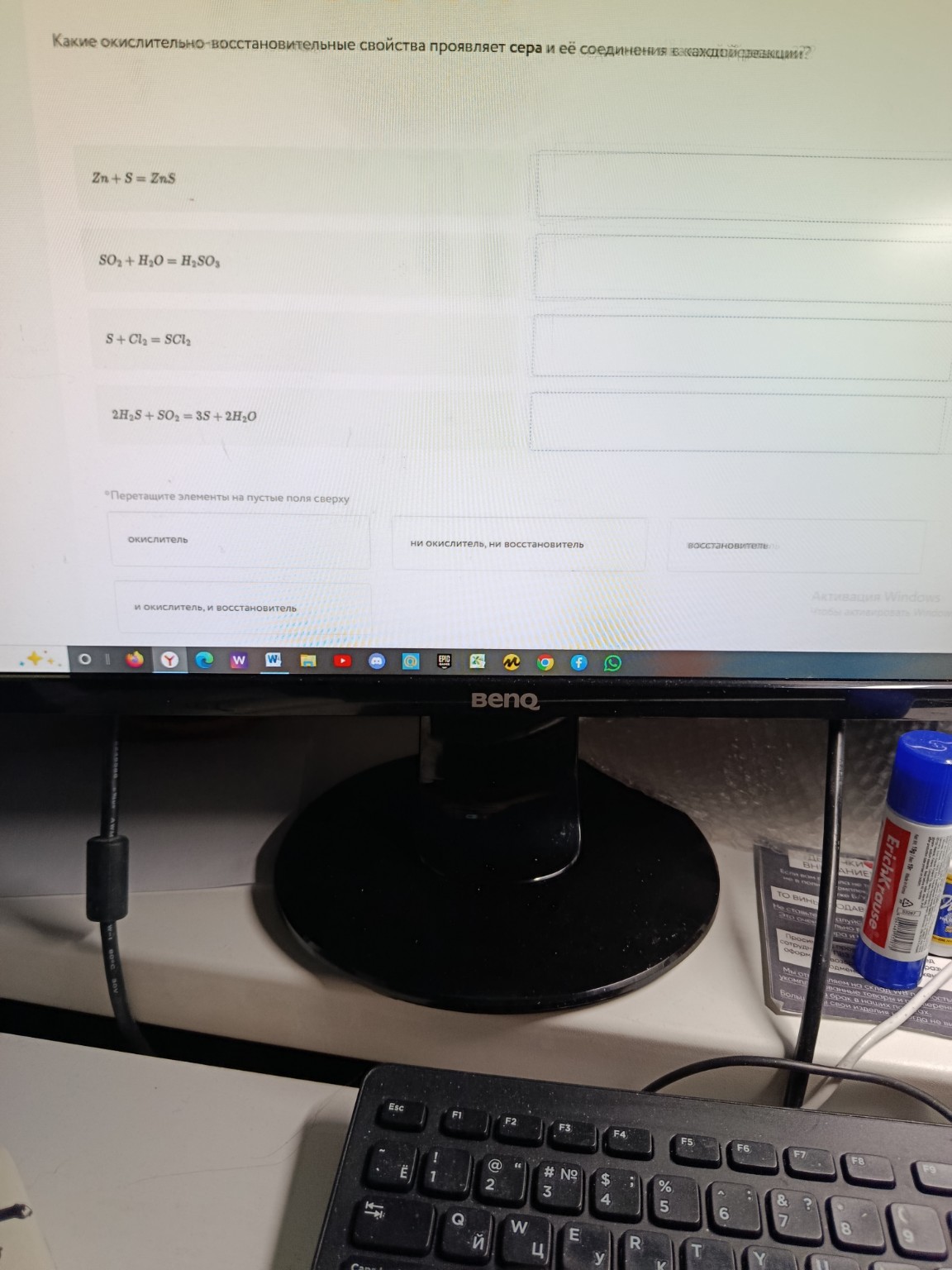
help_outlineУсловие задачи
lightbulbКраткий ответ
Для решения задачи необходимо определить изменение степени окисления серы. Если степень окисления понижается - сера окислитель, если повышается - восстановитель.
Подробное решение
Для решения этой задачи нужно определить, как меняется степень окисления серы в каждой реакции. Если степень окисления понижается — сера окислитель, если повышается — восстановитель. Если не меняется — ни то, ни другое.
Разберем каждую реакцию:
1. \(Zn + S = ZnS\)
Степень окисления серы меняется с \(0\) (в \(S\)) до \(-2\) (в \(ZnS\)).
Сера принимает электроны, её степень окисления понижается.
Ответ: **окислитель**
2. \(SO_2 + H_2O = H_2SO_3\)
Степень окисления серы в \(SO_2\) равна \(+4\), в \(H_2SO_3\) она также равна \(+4\).
Это не окислительно-восстановительная реакция.
Ответ: **ни окислитель, ни восстановитель**
3. \(S + Cl_2 = SCl_2\)
Степень окисления серы меняется с \(0\) (в \(S\)) до \(+2\) (в \(SCl_2\)), так как хлор более электроотрицателен (\(-1\)).
Сера отдает электроны, её степень окисления повышается.
Ответ: **восстановитель**
4. \(2H_2S + SO_2 = 3S + 2H_2O\)
Здесь сера присутствует в двух реагентах:
- В \(H_2S\) степень окисления \(-2\), она повышается до \(0\) (восстановитель).
- В \(SO_2\) степень окисления \(+4\), она понижается до \(0\) (окислитель).
Так как вопрос про "серу и её соединения" в рамках всей реакции:
Ответ: **и окислитель, и восстановитель**
Запись в тетрадь:
1. \(S^0 \rightarrow S^{-2}\) (понижение) — окислитель.
2. \(S^{+4} \rightarrow S^{+4}\) (без изменений) — ни окислитель, ни восстановитель.
3. \(S^0 \rightarrow S^{+2}\) (повышение) — восстановитель.
4. \(S^{-2} \rightarrow S^0\) и \(S^{+4} \rightarrow S^0\) — и окислитель, и восстановитель.