schoolМатематика
verifiedРешено AI
Решение задачи: расчет массы серной кислоты для обработки фосфорита
help_outlineУсловие задачи
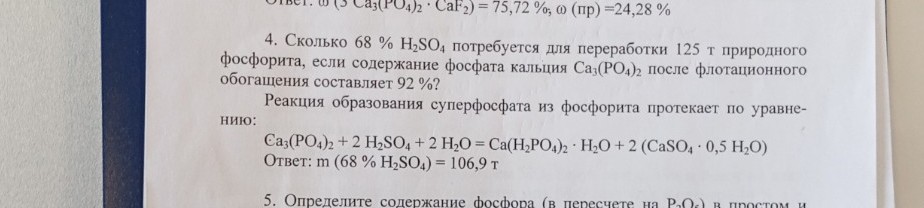
lightbulbКраткий ответ
Для обработки 125 т фосфорита с содержанием 92% Ca3(PO4)2 потребуется расчетное количество раствора серной кислоты с концентрацией 68%. Смотрите подробное решение с химической реакцией и расчетами.
Подробное решение
Задача №4
Дано:
\(m_{\text{фосфорита}} = 125 \text{ т}\)
\(\omega(\text{Ca}_3(\text{PO}_4)_2) = 92 \% = 0,92\)
\(\omega(\text{H}_2\text{SO}_4) = 68 \% = 0,68\)
Найти:
\(m(\text{р-ра H}_2\text{SO}_4) - ?\)
Решение:
1. Найдем массу чистого фосфата кальция в природном фосфорите:
\[m(\text{Ca}_3(\text{PO}_4)_2) = m_{\text{фосфорита}} \cdot \omega(\text{Ca}_3(\text{PO}_4)_2)\]
\[m(\text{Ca}_3(\text{PO}_4)_2) = 125 \text{ т} \cdot 0,92 = 115 \text{ т}\]
2. Составим уравнение химической реакции:
\[\text{Ca}_3(\text{PO}_4)_2 + 2\text{H}_2\text{SO}_4 + 2\text{H}_2\text{O} = \text{Ca}(\text{H}_2\text{PO}_4)_2 \cdot \text{H}_2\text{O} + 2(\text{CaSO}_4 \cdot 0,5\text{H}_2\text{O})\]
3. Рассчитаем молярные массы веществ:
\[M(\text{Ca}_3(\text{PO}_4)_2) = 3 \cdot 40 + 2 \cdot (31 + 4 \cdot 16) = 310 \text{ г/моль}\]
\[M(\text{H}_2\text{SO}_4) = 2 \cdot 1 + 32 + 4 \cdot 16 = 98 \text{ г/моль}\]
4. Определим массу чистой серной кислоты, необходимой для реакции.
По уравнению реакции 1 моль \(\text{Ca}_3(\text{PO}_4)_2\) реагирует с 2 моль \(\text{H}_2\text{SO}_4\).
Составим пропорцию:
115 т \(\text{Ca}_3(\text{PO}_4)_2\) — \(x\) т \(\text{H}_2\text{SO}_4\)
310 г/моль — \(2 \cdot 98\) г/моль
\[x = \frac{115 \cdot 2 \cdot 98}{310} \approx 72,71 \text{ т (чистой H}_2\text{SO}_4)\]
5. Вычислим массу 68 % раствора серной кислоты:
\[m(\text{р-ра H}_2\text{SO}_4) = \frac{m(\text{H}_2\text{SO}_4)}{\omega(\text{H}_2\text{SO}_4)}\]
\[m(\text{р-ра H}_2\text{SO}_4) = \frac{72,71 \text{ т}}{0,68} \approx 106,9 \text{ т}\]
Ответ: \(m(68 \% \text{ H}_2\text{SO}_4) = 106,9 \text{ т}\).