schoolХимия
verifiedРешено AI
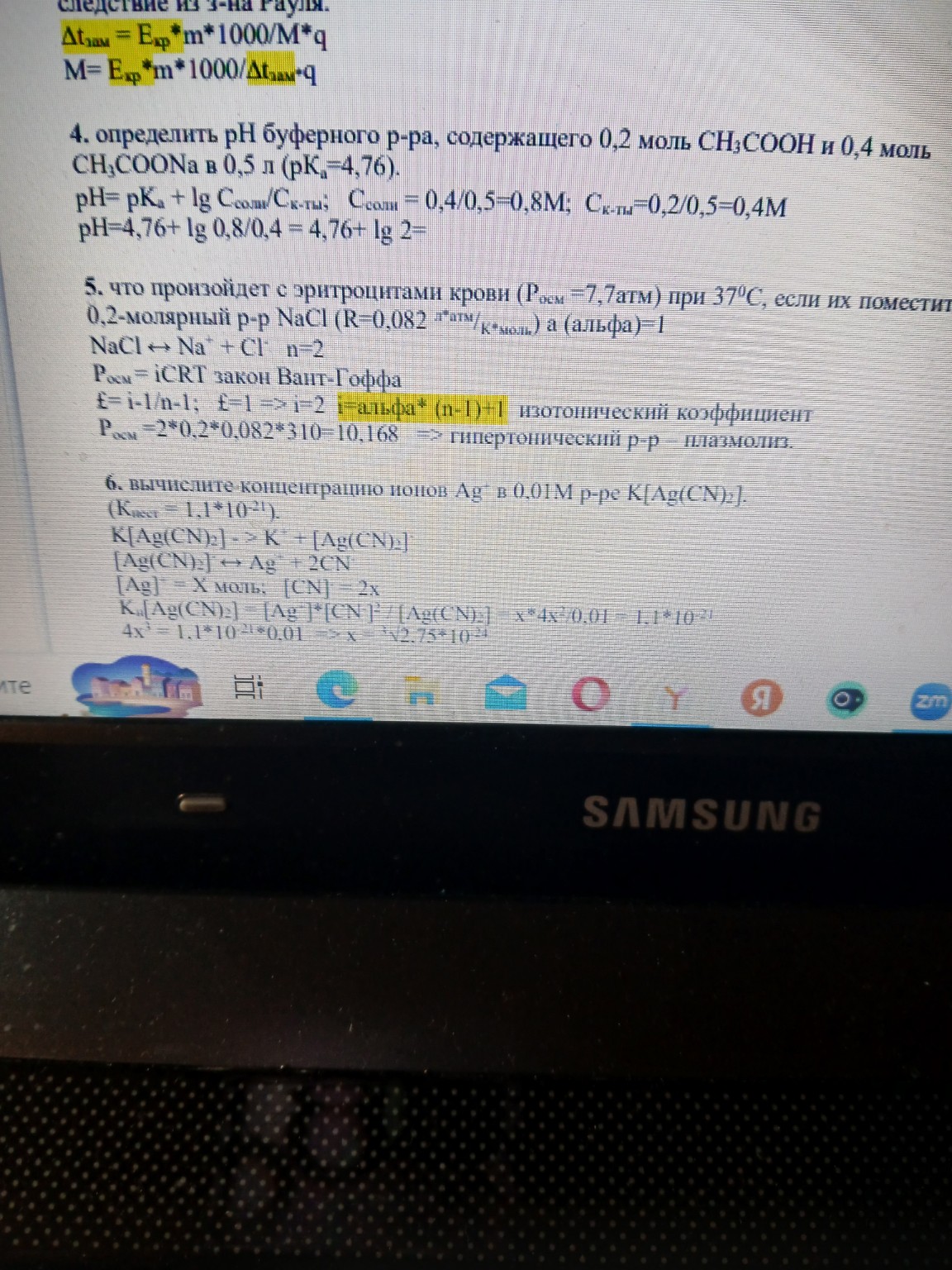
Решение задач №4, №5 и №6 по химии
help_outlineУсловие задачи
lightbulbКраткий ответ
Здесь представлены решения задач по химии, включая расчет pH буферного раствора и осмотического давления эритроцитов. Подробные объяснения помогут вам разобраться в теме.
Подробное решение
Вот решение задач №4, №5 и №6 с вашего изображения, оформленное для записи в тетрадь.
Задача №4
Дано:
\(n(CH_3COOH) = 0,2 \, моль\)
\(n(CH_3COONa) = 0,4 \, моль\)
\(V = 0,5 \, л\)
\(pK_a = 4,76\)
Найти: \(pH - ?\)
Решение:
1. Рассчитаем молярные концентрации компонентов буферного раствора:
\[C_{к-ты} = \frac{n(CH_3COOH)}{V} = \frac{0,2}{0,5} = 0,4 \, моль/л\]
\[C_{соли} = \frac{n(CH_3COONa)}{V} = \frac{0,4}{0,5} = 0,8 \, моль/л\]
2. Используем уравнение Гендерсона-Хассельбаха для pH буферного раствора:
\[pH = pK_a + \lg \frac{C_{соли}}{C_{к-ты}}\]
\[pH = 4,76 + \lg \frac{0,8}{0,4} = 4,76 + \lg 2\]
\[\lg 2 \approx 0,301\]
\[pH = 4,76 + 0,301 = 5,061\]
Ответ: 5,061.
---
Задача №5
Дано:
\(P_{осм. эритр.} = 7,7 \, атм\)
\(T = 37^\circ C = 310 \, К\)
\(C_M(NaCl) = 0,2 \, моль/л\)
\(R = 0,082 \, \frac{л \cdot атм}{К \cdot моль}\)
\(\alpha = 1\)
Найти: \(P_{осм. р-ра} - ?\) и описать явление.
Решение:
1. Находим изотонический коэффициент \(i\) для \(NaCl\):
\(NaCl \rightarrow Na^+ + Cl^-\) (число ионов \(n = 2\))
\[i = 1 + \alpha(n - 1) = 1 + 1(2 - 1) = 2\]
2. Рассчитаем осмотическое давление раствора по закону Вант-Гоффа:
\[P_{осм} = i \cdot C_M \cdot R \cdot T\]
\[P_{осм} = 2 \cdot 0,2 \cdot 0,082 \cdot 310 = 10,168 \, атм\]
3. Сравним давления:
\(P_{осм. р-ра} (10,168 \, атм) > P_{осм. эритр.} (7,7 \, атм)\).
Раствор является гипертоническим по отношению к эритроцитам.
Вывод: Вода будет выходить из эритроцитов в более концентрированный раствор, произойдет их сморщивание — плазмолиз.
---
Задача №6
Дано:
\(C_M(K[Ag(CN)_2]) = 0,01 \, М\)
\(K_{нест} = 1,1 \cdot 10^{-21}\)
Найти: \([Ag^+] - ?\)
Решение:
1. Соль диссоциирует полностью:
\(K[Ag(CN)_2] \rightarrow K^+ + [Ag(CN)_2]^-\)
Концентрация комплексного иона \([[Ag(CN)_2]^-] = 0,01 \, М\).
2. Запишем уравнение диссоциации комплексного иона (вторичная диссоциация):
\([Ag(CN)_2]^- \rightleftarrows Ag^+ + 2CN^-\)
3. Пусть \([Ag^+] = x\), тогда \([CN^-] = 2x\).
Выражение для константы нестойкости:
\[K_{нест} = \frac{[Ag^+][CN^-]^2}{[[Ag(CN)_2]^-]}\]
\[1,1 \cdot 10^{-21} = \frac{x \cdot (2x)^2}{0,01} = \frac{4x^3}{0,01}\]
4. Решим уравнение относительно \(x\):
\[4x^3 = 1,1 \cdot 10^{-21} \cdot 0,01 = 1,1 \cdot 10^{-23}\]
\[x^3 = \frac{1,1 \cdot 10^{-23}}{4} = 2,75 \cdot 10^{-24}\]
\[x = \sqrt[3]{2,75 \cdot 10^{-24}} \approx 1,4 \cdot 10^{-8} \, моль/л\]
Ответ: \([Ag^+] = 1,4 \cdot 10^{-8} \, моль/л\).