schoolМатематика
verifiedРешено AI
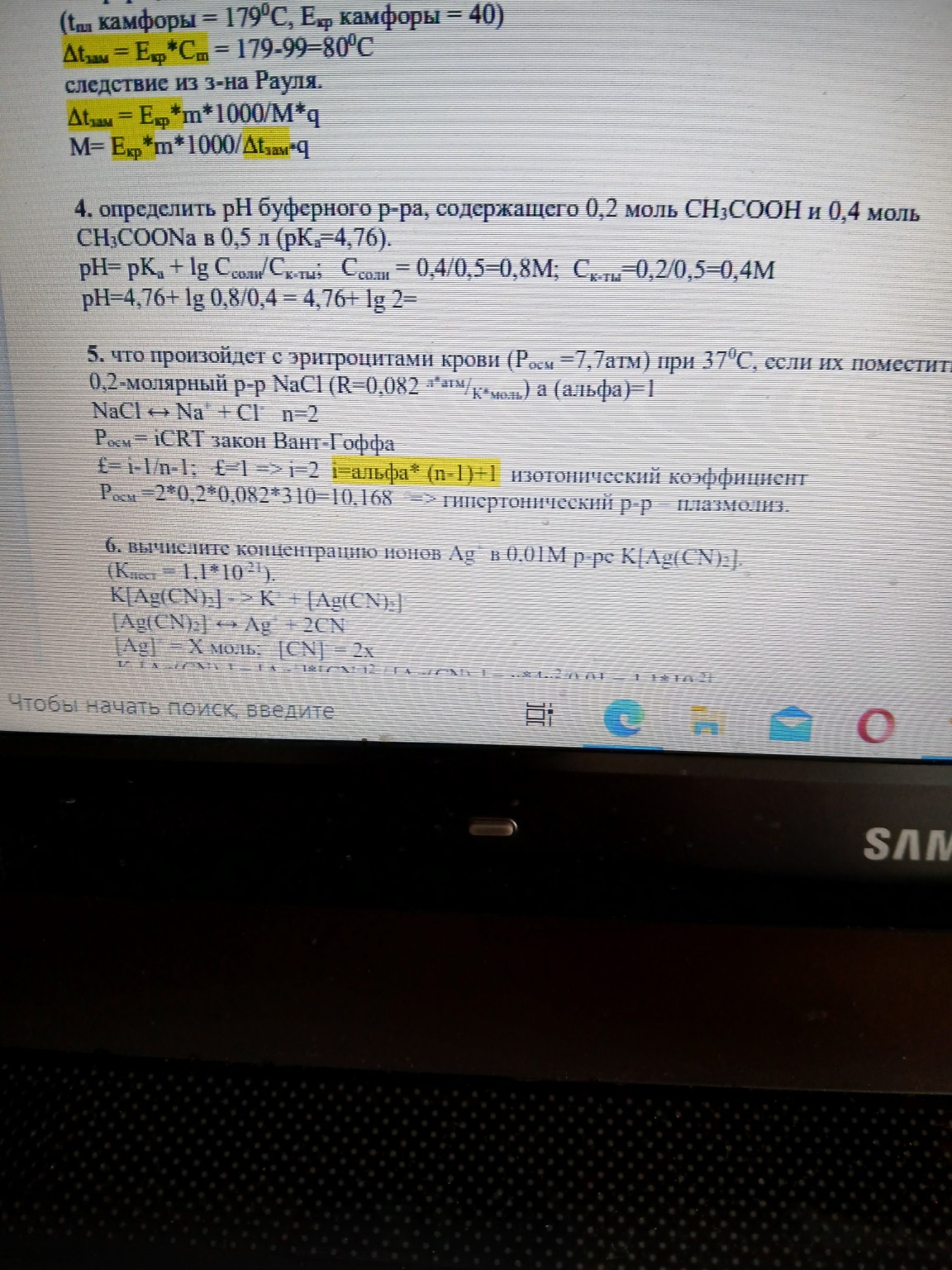
Решение задач №4, №5 и №6 по химии
help_outlineУсловие задачи
lightbulbКраткий ответ
На странице представлено подробное решение задач по химии: расчет pH ацетатного буфера, осмотического давления крови и растворимости AgCl. Решение оформлено для удобного переписывания в тетрадь.
Подробное решение
Ниже представлено решение задач №4, №5 и №6 с оформлением, удобным для переписывания в школьную тетрадь.
Задача №4
Дано:
\(n(CH_{3}COOH) = 0,2\) моль
\(n(CH_{3}COONa) = 0,4\) моль
\(V = 0,5\) л
\(pK_{a} = 4,76\)
Найти: \(pH\) — ?
Решение:
Для расчета \(pH\) ацетатного буферного раствора воспользуемся уравнением Гендерсона-Хассельбаха:
\[pH = pK_{a} + \lg \frac{C_{соли}}{C_{кислоты}}\]
Так как объем раствора для обоих компонентов одинаков, отношение концентраций равно отношению количеств вещества:
\[\frac{C_{соли}}{C_{кислоты}} = \frac{n_{соли} / V}{n_{кислоты} / V} = \frac{n_{соли}}{n_{кислоты}}\]
Подставим значения:
\[pH = 4,76 + \lg \frac{0,4}{0,2} = 4,76 + \lg 2\]
Зная, что \(\lg 2 \approx 0,301\):
\[pH = 4,76 + 0,301 = 5,061\]
Ответ: \(pH = 5,061\).
Задача №5
Дано:
\(P_{осм.крови} = 7,7\) атм
\(t = 37^{\circ}C \Rightarrow T = 310\) К
\(C_{M}(NaCl) = 0,2\) М
\(R = 0,082 \frac{л \cdot атм}{К \cdot моль}\)
\(\alpha = 1\)
Найти: что произойдет с эритроцитами?
Решение:
1. Уравнение диссоциации соли: \(NaCl \rightarrow Na^{+} + Cl^{-}\). Число ионов \(n = 2\).
2. Вычислим изотонический коэффициент:
\[i = 1 + \alpha(n - 1) = 1 + 1(2 - 1) = 2\]
3. Вычислим осмотическое давление раствора \(NaCl\) по закону Вант-Гоффа:
\[P_{осм} = i \cdot C_{M} \cdot R \cdot T\]
\[P_{осм} = 2 \cdot 0,2 \cdot 0,082 \cdot 310 = 10,168\) атм
4. Сравним давления: \(10,168\) атм \(>\) \(7,7\) атм.
Раствор является гипертоническим по отношению к крови. В такой среде вода будет выходить из эритроцитов в раствор.
Ответ: произойдет плазмолиз (сморщивание эритроцитов).
Задача №6
Дано:
\(C(K[Ag(CN)_{2}]) = 0,01\) М
\(K_{нест} = 1,1 \cdot 10^{-21}\)
Найти: \([Ag^{+}]\) — ?
Решение:
1. Комплексная соль диссоциирует полностью:
\(K[Ag(CN)_{2}] \rightarrow K^{+} + [Ag(CN)_{2}]^{-}\)
Следовательно, \([[Ag(CN)_{2}]^{-}] = 0,01\) М.
2. Диссоциация комплексного иона (вторичная):
\([Ag(CN)_{2}]^{-} \rightleftharpoons Ag^{+} + 2CN^{-}\)
Пусть \([Ag^{+}] = x\) моль/л, тогда \([CN^{-}] = 2x\) моль/л.
3. Выражение для константы нестойкости:
\[K_{нест} = \frac{[Ag^{+}] \cdot [CN^{-}]^{2}}{[[Ag(CN)_{2}]^{-}]}\]
\[1,1 \cdot 10^{-21} = \frac{x \cdot (2x)^{2}}{0,01}\]
\[1,1 \cdot 10^{-21} = \frac{4x^{3}}{0,01}\]
\[4x^{3} = 1,1 \cdot 10^{-23}\]
\[x^{3} = 0,275 \cdot 10^{-23} = 2,75 \cdot 10^{-24}\]
\[x = \sqrt[3]{2,75 \cdot 10^{-24}} \approx 1,4 \cdot 10^{-8}\]
Ответ: \([Ag^{+}] = 1,4 \cdot 10^{-8}\) моль/л.