schoolХимия
verifiedРешено AI
Решение задачи: Переходы электронов и реакции азота
help_outlineУсловие задачи
lightbulbКраткий ответ
В задании рассматриваются окислительно-восстановительные реакции с участием азота. Определяются процессы окисления и восстановления азота в различных соединениях и химических реакциях.
Подробное решение
Решения заданий со второй страницы:
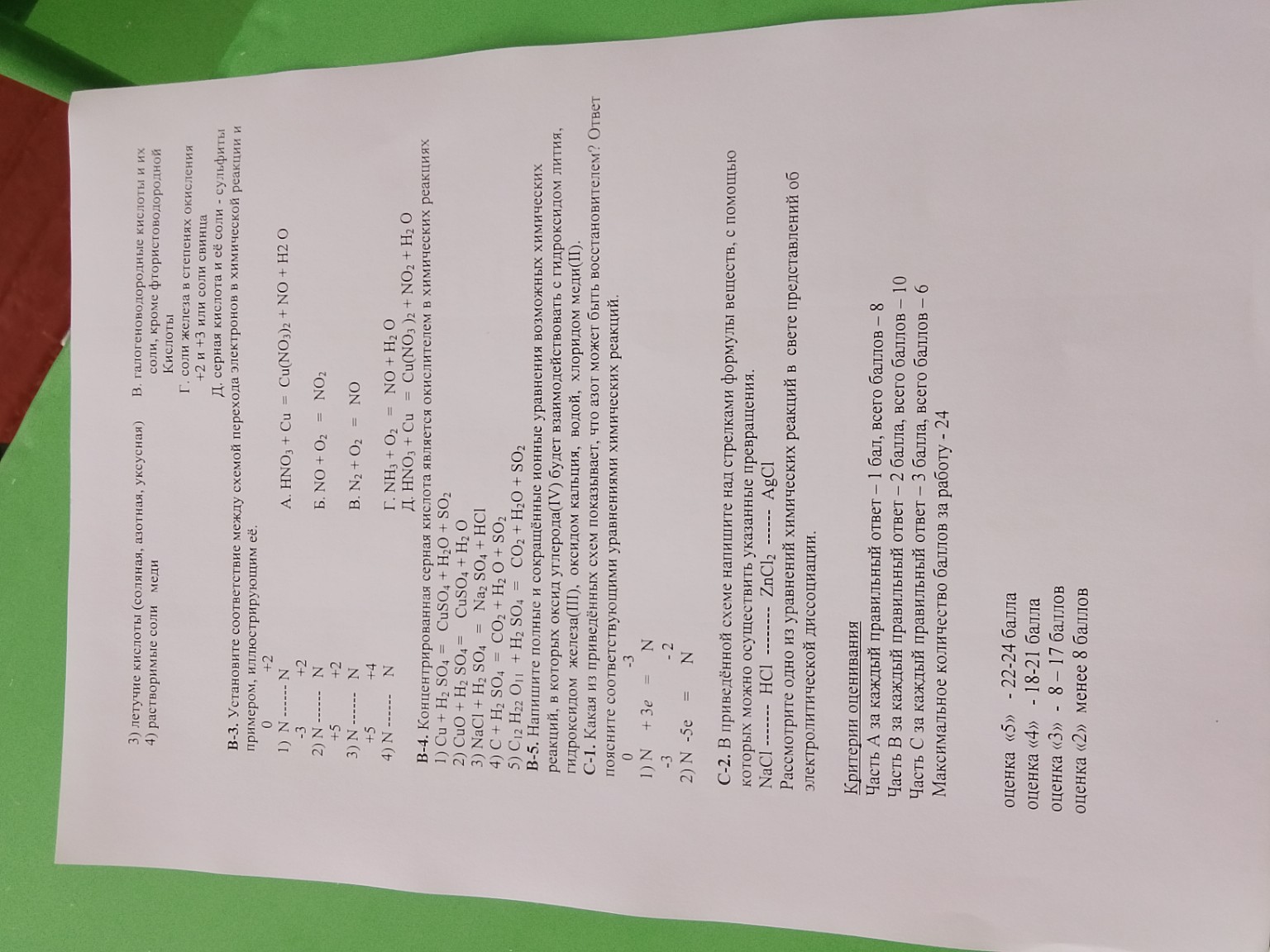
В-3. Установите соответствие между схемой перехода электронов и химической реакцией:
1) \(N^0 \rightarrow N^{+2}\) — Азот отдает электроны (окисляется). Это реакция горения азота: \(N_2 + O_2 = 2NO\). (Ответ: В)
2) \(N^{-3} \rightarrow N^{+2}\) — Азот в аммиаке повышает степень окисления. Это каталитическое окисление аммиака: \(4NH_3 + 5O_2 = 4NO + 6H_2O\). (Ответ: Г)
3) \(N^{+5} \rightarrow N^{+2}\) — Азот принимает электроны (восстанавливается). Это реакция меди с разбавленной азотной кислотой. (Ответ: А)
4) \(N^{+5} \rightarrow N^{+4}\) — Азот принимает 1 электрон. Это реакция меди с концентрированной азотной кислотой. (Ответ: Д)
В-4. Концентрированная серная кислота является окислителем в реакциях:
Концентрированная \(H_2SO_4\) проявляет свойства окислителя при взаимодействии с металлами (кроме простых реакций замещения водорода) и неметаллами.
1) \(Cu + 2H_2SO_4(конц) = CuSO_4 + SO_2 + 2H_2O\) (Да, сера \(+6 \rightarrow +4\))
4) \(C + 2H_2SO_4(конц) = CO_2 + 2SO_2 + 2H_2O\) (Да, сера \(+6 \rightarrow +4\))
Ответ: 1, 4
В-5. Реакции оксида углерода(IV) \(CO_2\):
\(CO_2\) — кислотный оксид, реагирует с основаниями и основными оксидами.
1) С гидроксидом лития:
Молекулярное: \(CO_2 + 2LiOH = Li_2CO_3 + H_2O\)
Полное ионное: \(CO_2 + 2Li^+ + 2OH^- = 2Li^+ + CO_3^{2-} + H_2O\)
Сокращенное ионное: \(CO_2 + 2OH^- = CO_3^{2-} + H_2O\)
2) С оксидом кальция:
Молекулярное: \(CO_2 + CaO = CaCO_3\)
(Ионное уравнение для реакций между оксидами обычно не записывается, так как оксиды — неэлектролиты).
С-1. Какая из схем показывает, что азот может быть восстановителем?
Восстановитель — это тот, кто отдает электроны и повышает свою степень окисления.
Схема 2): \(N^{-3} - 5e^- = N^{+2}\)
Здесь азот отдает 5 электронов, повышая степень окисления с \(-3\) до \(+2\). Это процесс окисления, следовательно, азот — восстановитель.
Пример реакции: \(4NH_3 + 5O_2 \xrightarrow{kat} 4NO + 6H_2O\)
С-2. Цепочка превращений:
\(NaCl \xrightarrow{1} HCl \xrightarrow{2} ZnCl_2 \xrightarrow{3} AgCl\)
1) \(2NaCl(тв.) + H_2SO_4(конц.) = Na_2SO_4 + 2HCl \uparrow\)
2) \(Zn + 2HCl = ZnCl_2 + H_2 \uparrow\)
3) \(ZnCl_2 + 2AgNO_3 = Zn(NO_3)_2 + 2AgCl \downarrow\)
Рассмотрим реакцию 3 в свете электролитической диссоциации:
Молекулярное: \(ZnCl_2 + 2AgNO_3 = Zn(NO_3)_2 + 2AgCl \downarrow\)
Полное ионное: \(Zn^{2+} + 2Cl^- + 2Ag^+ + 2NO_3^- = Zn^{2+} + 2NO_3^- + 2AgCl \downarrow\)
Сокращенное ионное: \(Ag^+ + Cl^- = AgCl \downarrow\)