schoolХимия
verifiedРешено AI
Решение задачи: Cu2+ + 2OH- -> Cu(OH)2↓
help_outlineУсловие задачи
lightbulbКраткий ответ
Реакция Cu2+ + 2OH- -> Cu(OH)2↓ требует растворимых источников ионов Cu2+ и OH-. Подходящая пара: гидроксид калия и сульфат меди(II).
Подробное решение
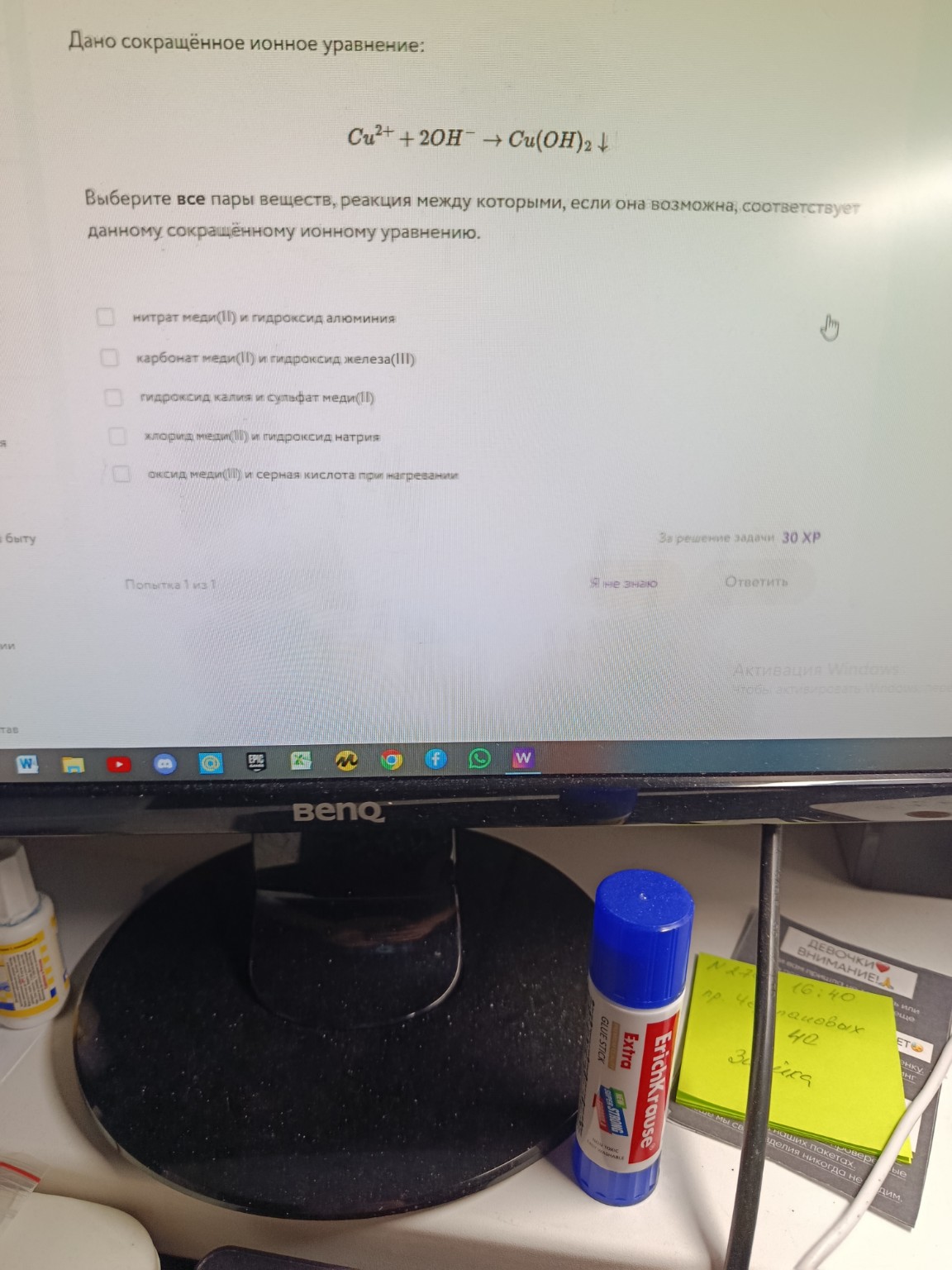
Дано сокращённое ионное уравнение:
\[Cu^{2+} + 2OH^{-} \rightarrow Cu(OH)_{2}\downarrow\]
Чтобы реакция соответствовала этому уравнению, оба исходных вещества должны быть растворимы в воде (сильные электролиты), так как в левой части уравнения мы видим свободные ионы.
Разберем предложенные пары:
1. Нитрат меди(II) и гидроксид алюминия.
Нитрат меди(II) \(Cu(NO_{3})_{2}\) растворим, но гидроксид алюминия \(Al(OH)_{3}\) — это нерастворимое основание. Реакция не пойдет по данному ионному уравнению.
2. Карбонат меди(II) и гидроксид железа(III).
Оба вещества нерастворимы в воде. Реакция между ними в обычных условиях не протекает.
3. Гидроксид калия и сульфат меди(II).
Гидроксид калия \(KOH\) — растворимая щелочь (источник \(OH^{-}\)). Сульфат меди(II) \(CuSO_{4}\) — растворимая соль (источник \(Cu^{2+}\)).
Молекулярное уравнение:
\[CuSO_{4} + 2KOH \rightarrow Cu(OH)_{2}\downarrow + K_{2}SO_{4}\]
Это полностью соответствует сокращённому ионному уравнению.
4. Хлорид меди(II) и гидроксид натрия.
Хлорид меди(II) \(CuCl_{2}\) растворим. Гидроксид натрия \(NaOH\) — растворимая щелочь.
Молекулярное уравнение:
\[CuCl_{2} + 2NaOH \rightarrow Cu(OH)_{2}\downarrow + 2NaCl\]
Это также соответствует сокращённому ионному уравнению.
5. Оксид меди(II) и серная кислота.
Оксид меди(II) \(CuO\) — твердое нерастворимое вещество. В результате реакции образуется вода, а не осадок гидроксида.
Правильные ответы:
- гидроксид калия и сульфат меди(II)
- хлорид меди(II) и гидроксид натрия