schoolХимия
verifiedРешено AI
Решение задачи: определение восстановителя в химической реакции
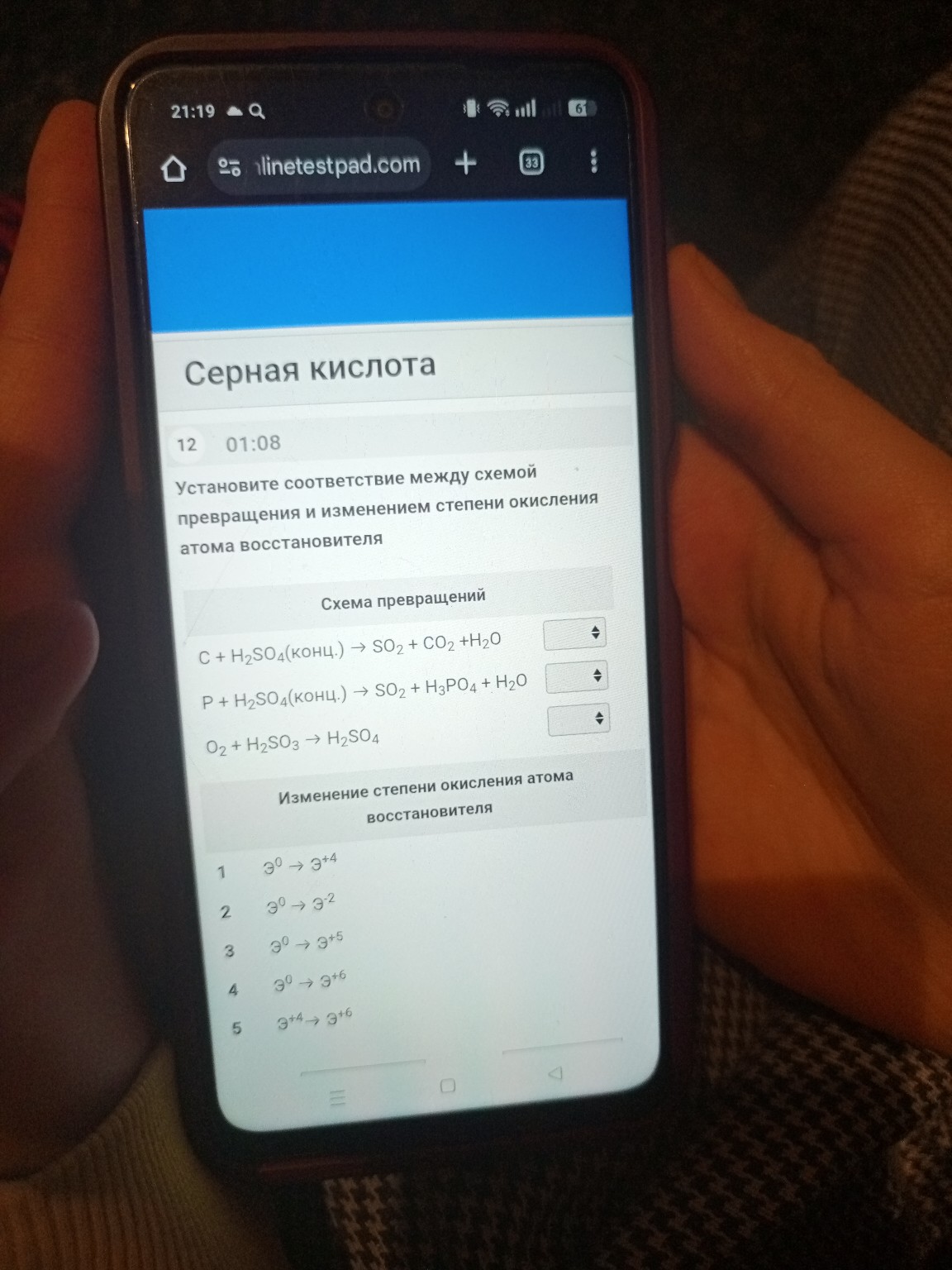
help_outlineУсловие задачи
lightbulbКраткий ответ
В данной задаче требуется определить восстановитель в предложенных химических реакциях. Восстановителем является атом, повышающий свою степень окисления в процессе реакции.
Подробное решение
Для решения этого задания необходимо определить восстановитель в каждой реакции (атом, который повышает свою степень окисления) и проследить её изменение.
Разберем каждую схему:
1. \( C + H_{2}SO_{4}(конц.) \rightarrow SO_{2} + CO_{2} + H_{2}O \)
Восстановителем является углерод \( C \). В левой части это простое вещество, его степень окисления \( 0 \). В правой части он входит в состав углекислого газа \( CO_{2} \), где его степень окисления \( +4 \).
Изменение: \( Э^{0} \rightarrow Э^{+4} \) (соответствует пункту 1).
2. \( P + H_{2}SO_{4}(конц.) \rightarrow SO_{2} + H_{3}PO_{4} + H_{2}O \)
Восстановителем является фосфор \( P \). Как простое вещество он имеет степень окисления \( 0 \). В составе ортофосфорной кислоты \( H_{3}PO_{4} \) степень окисления фосфора равна \( +5 \).
Изменение: \( Э^{0} \rightarrow Э^{+5} \) (соответствует пункту 3).
3. \( O_{2} + H_{2}SO_{3} \rightarrow H_{2}SO_{4} \)
В этой реакции окислителем является кислород \( O_{2} \), а восстановителем — сера \( S \). В сернистой кислоте \( H_{2}SO_{3} \) степень окисления серы \( +4 \). В серной кислоте \( H_{2}SO_{4} \) сера переходит в степень окисления \( +6 \).
Изменение: \( Э^{+4} \rightarrow Э^{+6} \) (соответствует пункту 5).
Итоговое соответствие:
Первая схема — 1
Вторая схема — 3
Третья схема — 5