schoolХимия
verifiedРешено AI
Решение задачи №4: Гидролиз солей - уравнения и тип
help_outlineУсловие задачи
Записать уравнения гидролиза солей указать тип гидролиза и среду образовавшегося раствора
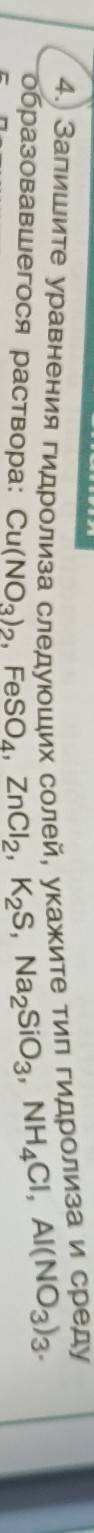
lightbulbКраткий ответ
Представлены уравнения гидролиза нитрата меди (II) и сульфата железа (II), определены типы гидролиза (по катиону) и показано, что среда растворов кислая (pH < 7).
Подробное решение
Задание №4. Гидролиз солей.
Ниже приведены уравнения гидролиза для каждой соли в молекулярном и ионном виде, указан тип гидролиза и характер среды.
1. Нитрат меди (II) \( Cu(NO_3)_2 \)
Соль образована слабым основанием \( Cu(OH)_2 \) и сильной кислотой \( HNO_3 \).
Тип гидролиза: по катиону.
I ступень:
Ионное уравнение: \( Cu^{2+} + H_2O \rightleftharpoons CuOH^+ + H^+ \)
Молекулярное уравнение: \( Cu(NO_3)_2 + H_2O \rightleftharpoons CuOHNO_3 + HNO_3 \)
Среда: кислая (\( pH < 7 \)).
2. Сульфат железа (II) \( FeSO_4 \)
Соль образована слабым основанием \( Fe(OH)_2 \) и сильной кислотой \( H_2SO_4 \).
Тип гидролиза: по катиону.
I ступень:
Ионное уравнение: \( Fe^{2+} + H_2O \rightleftharpoons FeOH^+ + H^+ \)
Молекулярное уравнение: \( 2FeSO_4 + 2H_2O \rightleftharpoons (FeOH)_2SO_4 + H_2SO_4 \)
Среда: кислая (\( pH < 7 \)).
3. Хлорид цинка \( ZnCl_2 \)
Соль образована слабым основанием \( Zn(OH)_2 \) и сильной кислотой \( HCl \).
Тип гидролиза: по катиону.
I ступень:
Ионное уравнение: \( Zn^{2+} + H_2O \rightleftharpoons ZnOH^+ + H^+ \)
Молекулярное уравнение: \( ZnCl_2 + H_2O \rightleftharpoons ZnOHCl + HCl \)
Среда: кислая (\( pH < 7 \)).
4. Сульфид калия \( K_2S \)
Соль образована сильным основанием \( KOH \) и слабой кислотой \( H_2S \).
Тип гидролиза: по аниону.
I ступень:
Ионное уравнение: \( S^{2-} + H_2O \rightleftharpoons HS^- + OH^- \)
Молекулярное уравнение: \( K_2S + H_2O \rightleftharpoons KHS + KOH \)
Среда: щелочная (\( pH > 7 \)).
5. Силикат натрия \( Na_2SiO_3 \)
Соль образована сильным основанием \( NaOH \) и слабой кислотой \( H_2SiO_3 \).
Тип гидролиза: по аниону.
I ступень:
Ионное уравнение: \( SiO_3^{2-} + H_2O \rightleftharpoons HSiO_3^- + OH^- \)
Молекулярное уравнение: \( Na_2SiO_3 + H_2O \rightleftharpoons NaHSiO_3 + NaOH \)
Среда: щелочная (\( pH > 7 \)).
6. Хлорид аммония \( NH_4Cl \)
Соль образована слабым основанием \( NH_3 \cdot H_2O \) и сильной кислотой \( HCl \).
Тип гидролиза: по катиону.
Ионное уравнение: \( NH_4^+ + H_2O \rightleftharpoons NH_3 \cdot H_2O + H^+ \)
Молекулярное уравнение: \( NH_4Cl + H_2O \rightleftharpoons NH_3 \cdot H_2O + HCl \)
Среда: кислая (\( pH < 7 \)).
7. Нитрат алюминия \( Al(NO_3)_3 \)
Соль образована слабым основанием \( Al(OH)_3 \) и сильной кислотой \( HNO_3 \).
Тип гидролиза: по катиону.
I ступень:
Ионное уравнение: \( Al^{3+} + H_2O \rightleftharpoons AlOH^{2+} + H^+ \)
Молекулярное уравнение: \( Al(NO_3)_3 + H_2O \rightleftharpoons AlOH(NO_3)_2 + HNO_3 \)
Среда: кислая (\( pH < 7 \)).