schoolХимия
verifiedРешено AI
Решение задачи: Реакции обмена
help_outlineУсловие задачи
заполнить таблицу Реши задачу: реакция обмена
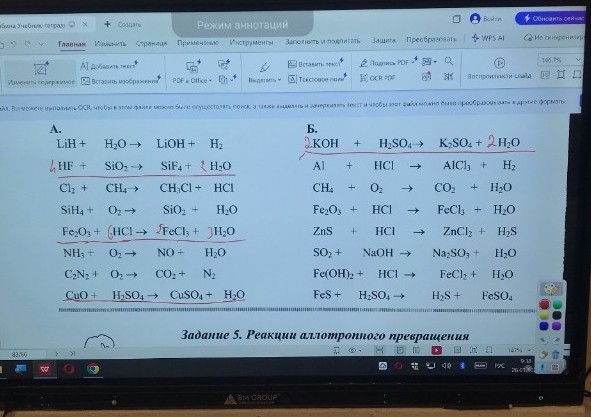
lightbulbКраткий ответ
Реакции обмена - это реакции, где два сложных вещества обмениваются своими составными частями. В данном решении представлены примеры реакций обмена с расставленными коэффициентами.
Подробное решение
Для того чтобы выполнить задание, необходимо расставить коэффициенты в уравнениях реакций обмена. Реакция обмена — это реакция, в которой два сложных вещества обмениваются своими составными частями.
Ниже приведены уравнения реакций обмена из представленного списка с расставленными коэффициентами:
Столбец А (реакции обмена):
1. Взаимодействие оксида железа (III) с соляной кислотой:
\[ Fe_{2}O_{3} + 6HCl \rightarrow 2FeCl_{3} + 3H_{2}O \]
2. Взаимодействие оксида меди (II) с серной кислотой:
\[ CuO + H_{2}SO_{4} \rightarrow CuSO_{4} + H_{2}O \]
Столбец Б (реакции обмена):
1. Взаимодействие гидроксида калия с серной кислотой:
\[ 2KOH + H_{2}SO_{4} \rightarrow K_{2}SO_{4} + 2H_{2}O \]
2. Взаимодействие оксида железа (III) с соляной кислотой:
\[ Fe_{2}O_{3} + 6HCl \rightarrow 2FeCl_{3} + 3H_{2}O \]
3. Взаимодействие сульфида цинка с соляной кислотой:
\[ ZnS + 2HCl \rightarrow ZnCl_{2} + H_{2}S\uparrow \]
4. Взаимодействие гидроксида железа (II) с соляной кислотой:
\[ Fe(OH)_{2} + 2HCl \rightarrow FeCl_{2} + 2H_{2}O \]
5. Взаимодействие сульфида железа (II) с серной кислотой:
\[ FeS + H_{2}SO_{4} \rightarrow H_{2}S\uparrow + FeSO_{4} \]
Примечание для школьника:
В реакциях обмена степени окисления элементов не меняются. Чтобы правильно расставить коэффициенты, нужно уравнять количество атомов каждого химического элемента в левой и правой частях уравнения. Обычно сначала уравнивают металлы, затем кислотные остатки, и в последнюю очередь — водород и кислород.